Потенциальное использование мелатонина при заболеваниях пародонта
С.В. Орлова1,2, С.К. Зырянов1, Е.А. Никитина1,2, Ю.О. Тигай1, А.А. Орлова1, Г.А. Грабовский3
1 ФГАОУ ВО «Российский университет дружбы народов» имени Патриса Лумумбы
2 ГБУЗ Научно-практический центр детской психоневрологии департамента здравоохранения г. Москвы, Россия
3 ФГАОУ ВО «Российский Национальный Исследовательский Медицинский Университет им. Н.И. Пирогова» Министерства здравоохранения Российской Федерации
РЕЗЮМЕ
Мелатонин представляет собой индоламин, который секретируется не только в эпифизе, но и других органах, в частности слюнных железах. Многочисленные исследования показывают, что уровень мелатонина в слюне и сыворотке пациентов, страдающих заболеваниями пародонта, снижен, что позволяет предположить, что он может играть важную роль в защите тканей от повреждений, вызванных оксидативным стрессом. Мелатонин помогает регулировать иммунный ответ и предотвращает повреждение тканей пародонта. Включение мелатонина в схему лечения заболеваний пародонта повышает ее эффективность. Необходимы дальнейшие исследования для определения оптимальных форм и режимов дозирования мелатонина.
КЛЮЧЕВЫЕ СЛОВА: мелатонин, антиоксидант, иммуномодулятор, воспаление, циркадность ритма, биоритмы, заболевания пародонта.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Potential Use of Melatonin in Periodontal Disease
S.V. Orlova1,2, S.K. Zyryanov1, E.A. Nikitina1,2, Yu.O. Tigai1, A.A. Orlova1, G.A. Grabovsky3
1 Federal State Autonomous Educational Institution of Higher Education «Peoples’ Friendship University of Russia» named after Patrice Lumumba
2 Scientific and Practical Center for Child Psychoneurology, Moscow Department of Health, Russia
3 Federal State Autonomous Educational Institution of Higher Education «N.I. Pirogov Russian National Research Medical University» of the Ministry of Health of the Russian Federation
SUMMARY
Melatonin is an indoleamine that is secreted not only in the pineal gland, but also in other organs, in particular the salivary glands. Numerous studies show that melatonin levels in the saliva and serum of patients suffering from periodontal disease are reduced, suggesting that it may play an important role in protecting tissues from damage caused by oxidative stress. Melatonin helps regulate the immune response and prevents periodontal tissue damage. The inclusion of melatonin in the periodontal disease treatment regimen increases its effectiveness. Further research is needed to determine the optimal forms and dosing regimens for melatonin.
KEYWORDS: melatonin, antioxidant, immunomodulator, inflammation, circadian rhythm, biorhythms, periodontal disease.
CONFLICT OF INTEREST. The authors declare that they have no conflicts of interest.
Введение
Согласно докладу ВОЗ от 2022 года, около половины населения земного шара (3,5 миллиарда человек) страдает заболеваниями полости рта, что делает их самыми распространенными хроническими заболеваниями человечества, опережающими сердечно-сосудистую, онкологическую и эндокринную заболеваемость [1]. Тяжелые заболевания пародонта занимают второе место среди заболеваний полости рта после кариеса и выявляются примерно у 1 миллиарда человек [1]. Заболевания полости рта являются серьезной медико-социальной проблемой, приводящей к огромным экономическим затратам [2].
Из-за ограниченного доступа к профилактике и лечению, а также значительного старения населения в развитых странах распространенность тяжелых заболеваний пародонта за последние 30 лет выросла по расчетам на 24% [1]. Известно, что в развитии заболеваний пародонта принимает участие множество патогенетических механизмов: инфекционный и воспалительный процессы, нарушение костного метаболизма, изменение микробиома ротовой полости, оксидативный стресс и др. [3]. Поиск средств, способных оказывать влияние на один или несколько патологических механизмов, лежащих в основе развития заболеваний пародонта, является важной научной и клинической задачей. В последние годы внимание исследователей привлек мелатонин как вещество, обладающее антиоксидантными, противовоспалительными, иммуно- и остеомодулирующими свойствами.
Мелатонин
N-ацетил-5-метокситриптамин представляет собой индоламин, синтезируемый и секретируемый в соответствии с циркадным ритмом. Впервые мелатонин был выделен и описан в 1958 году профессором дерматологии Аароном Лернером [4] как вещество из эпифиза, влияющее на окраску кожи. Позднее были изучены антиоксидантный и другие физиологические эффекты мелатонина, а также установлено, что он образуется не только в эпифизе, но и в других органах и тканях (сетчатка, слюнные железы, костный мозг, кишечник и др.) [5, 6].
Синтез мелатонина в эпифизе проходит в два этапа. В начале из триптофана в процессе гидроксилирования и декарбоксилирования образуется серотонин. В темное время суток под действием N-ацетилтрансферазы серотонин превращается в N-ацетилсеротонин, а затем метилируется до конечной формы ферментом гидроксииндол-О-метилтрансферазой [7, 8]. После образования мелатонин не накапливается в эпифизе, а быстро поступает в кровь и спинномозговую жидкость.
Синтез мелатонина в периферических тканях происходит по тому же механизму, но зависит не столько от циркадных ритмов, сколько от действия других регулирующих факторов (например, приема пищи) [9]. Кишечник является основным внепинеальным источником мелатонина, концентрация этого индоламина в кишечнике в 400 раз выше, чем в эпифизе, и в 10–100 раз выше, чем в плазме [10]. Считается, что образующийся местно мелатонин действует преимущественно паракринно и не оказывает существенного влияния на его концентрацию в кровотоке.
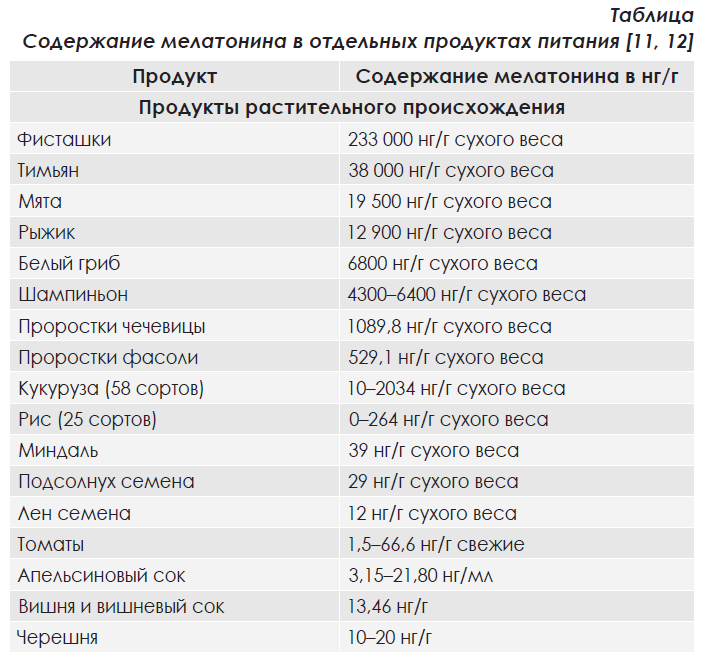
В организме человека обнаруживается не только эндогенно синтезированный мелатонин, но и поступивший с пищей. Мелатонин широко распространен в продуктах питания (таблица). Лидерами по содержанию мелатонина являются продукты растительного происхождения, такие как орехи (в первую очередь, фисташки), некоторые грибы, злаки, проростки семян и бобовых. Синтез мелатонина в растениях и его конечное количество зависит от сорта и условий выращивания. Мелатонин накапливается преимущественно в цветках, семенах и листьях растений, значительно меньше – в корнях и плодах. В группе овощей максимальное количество мелатонина обнаружено в томатах и перцах, в то время как в картофеле он практически не определяется. В продуктах животного происхождения содержание мелатонина существенно ниже и не превышает 4 нг/г.
В экспериментальных исследованиях было показано, что после употребления продуктов, богатых мелатонином, его концентрация в плазме животных возрастает более чем в два раза относительно базового дневного уровня в течение 2–4 часов и сохраняется повышенной до 24 часов [13, 14].
У людей после потребления фруктов, содержащих мелатонин, его концентрация в сыворотке возрастала ~ в 3 раза, достигая максимума через 2 часа после еды. Одновременно с этим наблюдалось повышение антиоксидантной способности сыворотки крови в тестах ORAC и FRAP [11, 15]. Остается открытым вопрос о том, вызвано ли повышение уровня мелатонина в крови только поступлением его извне или частично это эндогенный мелатонин, синтезирующийся в кишечнике и поступающий в системный кровоток под действием пока неизвестных компонентов пищи [16].
Единственное на данный момент крупное эпидемиологическое исследование, объединившее 29 079 жителей Японии старше 35 лет, показало, что человек потребляет с пищей в среднем 30,9±14,4 нг мелатонина в день. Основными источниками мелатонина выступали овощи (49,4%), злаки (33,6%) и яйца (4,8%). В группах овощей и злаков наибольший вклад в потребление мелатонина вносили, соответственно, лук и капуста (40,0%) и рис (32,5%) [17]. Вопрос о влиянии мелатонина, поступающего с пищей, на состояние пародонта остается открытым.
Концентрация эндогенного мелатонина в крови достигает максимума в середине темного периода суток и находится на низком уровне в течение светового дня. Около 70% мелатонина плазмы крови связано с альбумином, оставшиеся 30% находятся в свободной форме и способны диффундировать в окружающие ткани [6, 18]. Для мелатонина отсутствуют морфофизиологические барьеры: он быстро проникает через гематоэнцефалический барьер, плаценту и все другие потенциальные клеточные преграды [19].
Механизм действия мелатонина
В настоящее время мелатонин не считается гормоном в классическом смысле, поскольку он синтезируется во множестве органов и тканей и не оказывает воздействия на одну конкретную мишень [20]. Мелатонин обладает самостоятельным антиоксидантным действием, а также принимает участие в регуляции множества процессов напрямую взаимодействуя с внутриклеточными белками, такими как кальмодулин и кальретикулин, а также за счет связи с мембранными и ядерными рецепторами. Благодаря своим липофильным свойствам мелатонин способен проникать в внутриклеточные структуры и накапливаться в высокой концентрации в ядре и митохондриях, защищая их от свободнорадикального повреждения [21]. За счет прямого связывания с внутриклеточными белками мелатонин может регулировать их активность. Например, связываясь с кальмодулином, вторичным внутриклеточным посредником, мелатонин препятствует его взаимодействию с кальцием, обеспечивая антипролиферативный эффект при онкологических заболеваниях [22].
Рецепторы к мелатонину обнаружены практически у всех клеток организма: в головном мозге, сетчатке, сердечно-сосудистой системе, стенке желудочков сердца, аорте, коронарных и мозговых артериях, печени и желчном пузыре, коже, почках, адипоцитах, энтероцитах двенадцатиперстной кишки, толстой и слепой кишке и др. [22]. У человека выделяют 3 типа мембранных рецепторов и ядерные рецепторы RORα/RZRβ. Мембранные рецепторы МТ1 (Mel1a), МТ2 (Mel1b) и менее изученные МТ3 отличаются друг от друга молекулярной структурой, фармакологическими характеристиками и хромосомной локализацией. Рецепторы МТ1 и МТ2 относятся к семейству рецепторов, связанных с G-белками, и отвечают за регуляцию циркадного ритма, настроения, памяти и способности к обучению, репродуктивной функции, артериального давления, углеводного, жирового обмена и др. [9, 23]. Рецептор МТ3 не является собственно рецептором, а представляет собой фермент хинонредуктазу 2, которая относится к детоксицирующим и антиоксидантным энзимам [22, 24]. Предполагают, что, связываясь с хинонредуктазой 2, мелатонин выступает в качестве косубстрата и принимает участие в обмене ксенобиотиков. Ядерные рецепторы RZR/RORα относят к суперсемейству рецепторов ретиноевой кислоты. Связываясь с этим рецептором, мелатонин оказывает влияние на ядерные факторы транскрипции и регулирует иммунный ответ, клеточный рост и дифференцировку костей.
Свободный мелатонин из крови пассивно поступает в клетки крупных слюнных желез. Содержание мелатонина в слюне составляет 24–33% от его концентрации в плазме [18, 25]. Выводится мелатонин из ацинарных клеток за счет сокращения миоэпителиальных элементов ацинуса. Поскольку содержание мелатонина в слюне составляет 1/3–1/4 общего мелатонина в крови, определение мелатонина в слюне может использоваться как простой неинвазивный метод мониторинга секреции гормона и циркадных ритмов.
Теоретически, слюнные железы сами могут синтезировать мелатонин, однако их вклад в содержание мелатонина в слюне остается неизвестным. Shimozuma M. с соавт. иммуногистохимически идентифицировали экспрессию соответствующих ферментов в основных слюнных железах крысы и поднижнечелюстных железах человека [26]. Было показано, что акрилалкиламин N-ацетилтрансфераза и ацилсеротонинметилтрансфераза экспрессируются в миоэпителиальных клетках желез и превращают серотонин в мелатонин [25].
Мелатонин обнаружен в составе десневой жидкости [27], в дневное время его содержание у людей со здоровой полостью рта составляет 1,54–2,17 пг /мл.
Многочисленные исследования показали, что у людей с заболеваниями пародонта концентрация мелатонина в слюне и десневой жидкости снижена [28–31]. В опубликованном в 2022 г. метанализе было показано, что концентрация мелатонина у здоровых людей равна в среднем 5,27 ± 5,39 пг/мл, в то время как у пациентов с хроническим пародонтитом – 3,26 ± 3,44 пг/мл (p < 0,0001). Средняя разница составила 2,65 ± 7,84 пг/мл [32].
Необходимо отметить, что из 14 включенных в анализ исследований в 10 регистрировалось снижение концентрации мелатонина, в трех – начальное снижение уровня мелатонина с последующим его повышением при обострении пародонтита и в одном – повышение уровня мелатонина при переходе от здорового состояния к пародонтиту. Учитывая физиологические эффекты мелатонина и хронический характер заболевания, наблюдаемые результаты могут отражать динамическое изменение концентрации мелатонина. В начале заболевания повышение концентрации мелатонина, как антиоксиданта, противовоспалительного и иммуномодулирующего фактора, является ответом на возникшее воспаление, затем истощение запасов мелатонина приводят к срыву адаптации и хронизации патологического процесса в пародонте. После нехирургической пародонтальной терапии содержание мелатонина в слюне восстанавливается и коррелирует со снижением интенсивности местной воспалительной реакции [33].
Антимикробные свойства мелатонина
Антимикробные свойства мелатонина активно изучаются в последние годы [34]. Исследования in vitro показали, что мелатонин способен подавлять рост Pseudomonas aeruginosa, Acinetobacter baumannii и метициллин-резистентного золотистого стафилококка [35]. В исследованиях in vivo было показано иммуномодулирующее действие мелатонина, проявляющееся в уменьшении образования воспалительных цитокинов [36] и ускорении заживления повреждений, вызванных бактериями [37]. Однако данных о влиянии мелатонина на пародонтопатогенных бактерий пока мало.
Было обнаружено, что мелатонин и агонист мелатониновых рецепторов рамелтеон подавляют рост одного из главных возбудителей заболеваний пародонта – Porphyromonas gingivalis in vitro как в виде планктонной (свободно плавающей) культуры, так и в виде биопленки [38]. Наряду с антибактериальным действием у мелатонина была обнаружена способность подавлять воспаление, вызванное липополисахаридами P. gingivalis и Prevotella intermedia [38, 39]. Предполагают, что мелатонин может оказывать прямое или опосредованное действие и на другие оральные патогены, такие как Tannerella forsythia и Aggregatibacter actinomycetemcomitans. Учитывая способность P. gingivalis формировать устойчивые к действию множества антибактериальных препаратов персистирующие клетки, включение мелатонина в комплексные схемы лечения может быть потенциально полезным [40, 41] и нуждается в дальнейшем изучении.
Антиоксидантные свойства мелатонина
Перекисное окисление липидов является одним из основных факторов индукции и прогрессирования хронических заболеваний пародонта [42, 43]. Выход свободных радикалов из фагоцитов, таких как нейтрофилы и макрофаги, и миграция их к месту воспаления значительно повреждает десну [44]. У пациентов с хроническим пародонтитом снижена общая антиоксидантная способность и повышена концентрация маркеров свободнорадикального окисления: малонового диальдегида (МДА), оксида азота (NO), общего оксидантного статуса и 8-гидроксидезоксигуанозина в слюне и МДА в десневой жидкости [45]. Вредные привычки (курение) и заболевания (сахарный диабет 2 типа, ожирение и ревматоидный артрит), при которых наблюдается усиление образования свободных радикалов, оказывают негативное влияние на состояние пародонта [43].
Мелатонин является высокоэффективным акцептором свободных радикалов [46], хелатором переходных металлов, стимулятором антиоксидантных и ингибитором прооксидантных ферментов [47], легко проникающим через гистогематические барьеры и поступающим во внутриклеточные органеллы благодаря амфифильной природе [48]. По антиоксидантной активности ORAC (способность поглощать радикалы кислорода) мелатонин в два раза превосходит витамин Е [49]. Он связывает радикалы кислорода и азота, включая OH, O2−, и NO, а в сочетании с другими антиоксидантами повышает их активность.
Мелатонин способен влиять на энергообеспечение клеток, защищая мембраны митохондрий, цепь переноса электронов и митохондриальную ДНК от окислительного повреждения [48]. При сравнении с другими митохондриально-ориентированными антиоксидантами, такими как MitoQ и MitoE, мелатонин оказывает сходное или более сильное действие [14]. Благодаря высокой проникающей способности и комплексному антиоксидантному действию мелатонин уменьшает клеточные и молекулярные повреждения, вызванные различными видами свободных радикалов. В настоящее время он рассматривается как перспективное средство профилактики множества хронических заболеваний, включая болезнь Альцгеймера, метаболический синдром, гастроэзофагеальную рефлюксную болезнь, аутоиммунные заболевания и др. [14, 50, 51].
Ряд исследований подтверждает его способность предотвращать повреждение клеток, вызванное промышленными поллютантами, тяжелыми металлами и ионизирующей радиацией [52, 53]. Метилметакрилат, высвобождающийся в полость рта из полимерных зубопротезных конструкций, может поступать в системный кровоток и оказывать токсическое действие, включая цито- и генотоксичность [54, 55]. Метакрилатные мономеры могут взаимодействовать с ДНК лимфоцитов человека, вызывая одно- и двухцепочечные разрывы и изменения оснований ДНК, в том числе их окислительные модификации. Предполагают, что мелатонин может быть полезен для профилактики этих осложнений [54].
Операционные вмешательства, такие как удаление зубов, могут вызвать усиление свободнорадикального окисления и острую воспалительную реакцию. При внесении мелатонина в альвеолярные лунки наблюдалась нормализация повышенных показателей перекисного окисления липидов и концентрации нитритов и нитратов (NOx) в плазме у прооперированных животных [56].
Противовоспалительные свойства мелатонина
Заболевания, при которых происходит увеличение образования свободных радикалов и формируется хроническое вялотекущее воспаление (СД2, аутоиммунные процессы и т. д.), увеличивают риск развития заболеваний пародонта. В свою очередь хроническое воспаление пародонта и поступление микробных ЛПС в системный кровоток вызывают изменения в клетках, расположенных далеко от полости рта, например, в сосудах, почках, печени и др. Ограничивая тяжесть периодонтита, мелатонин защищает другие органы от повреждения [57].
Именно воспаление лежит в основе хронических заболеваний и деструкции пародонта. Используемые в настоящее время противовоспалительные препараты, как стероидные, так и нестероидные, обладают отдельными неблагоприятными побочными эффектами, ограничивающими их длительное применение [58, 59]. Мелатонин, обладая выраженным противовоспалительным действием и небольшим количеством побочных эффектов, рассматривается как перспективное средство для профилактики и лечения заболеваний пародонта [60].
Липополисахариды грамотрицательных бактерий ротовой полости (P. gingivalis и др.) стимулируют образование цитокинов, таких как ИЛ-1β и ФНО-α, и экспрессию матриксных металлопротеиназ (ММП), которые разрушают соединительные ткани пародонта [61]. Полиморфноядерные нейтрофилы мигрируют из кровеносных сосудов в очаг воспаления и наряду с макрофагами генерируют образование свободных радикалов и провоспалительных цитокинов, которые разрушают ткани десны. Растворение периодонтальной связки и потеря костной массы могут привести к потере зуба [62].
При остром воспалении мелатонин может связываться с активными участками циклооксигеназы, подобно индометацину, и подавлять возникновение воспалительной реакции [63]. Прием мелатонина способен подавлять миграцию полиморфноядерных лейкоцитов и снижать высвобождения провоспалительных простагландинов [64].
Мелатонин показал высокую профилактическую и терапевтическую эффективность в экспериментальных исследованиях по индуцированному острому периодонтиту у крыс. Введение мелатонина животным способствовало уменьшению уровня противовоспалительных цитокинов, ИЛ-1β и ФНО-α в сыворотке крови. Он также способствовал снижению повышенной активности TLR4/MyD88 и опосредованной ими воспалительной реакции. Прием мелатонина был ассоциирован с нормализацией повышенного соотношения RANKL/OPG – ключевого звена гомеостаза костной ткани, непосредственно регулирующего дифференцировку остеокластов и остеолиз [27, 65].
В культуре клеток периодонтальной связки человека мелатонин снижал индуцированную ИЛ-1β продукцию хемокина CXCL-10, ММП-1 и увеличивал образование тканевого ингибитора металлопротеиназы-1 (TIMP-1) [66]. Мелатонин играет иммуномодулирующую роль, регулируя секрецию интерферона-альфа (INF-α) и последующую активацию CD4+ лимфоцитов [67].
Мелатонин является мощным ингибитором ядерного фактора κB (NFĸB), в результате применения которого уменьшается образование ИЛ-1β и ФНО-α при периодонтите [68]. Исследование эпифизэктомированных крыс с заболеванием пародонта показало снижение концентрации ФНО-α в плазме и отсутствие резорбции альвеолярной кости после приема мелатонина (5 мг/кг) [69]. У пациентов с СД 2 типа и заболеванием пародонта мелатонин способствует повышению антиоксидантной активности сыворотки, снижению концентрации ИЛ-6, высокочувствительного СРБ и матриксной металлопротеиназы-9 (ММП-9) [68].
Анальгетические свойства мелатонина
Первые данные о потенциальном влиянии мелатонина на болевую чувствительность появились в 1969 году [70]. С тех пор было проведено большое количество исследований по изучению анальгетического действия мелатонина в отношении острой и хронической боли, однако точный механизм до сих пор не установлен. Предполагают, что мелатонин опосредует свое действие за счет влияния на ГАМК-рецепторы, β-эндорфиновые, опиоидные μ-рецепторы и NO-аргининовый путь [71, 72].
При возникновении острой болевой реакции концентрация мелатонина в слюне падает уже через 5 минут, затем кратковременно и незначительно повышается за счет усиления работы эпифиза, но все равно остается ниже исходного уровня [73]. Дополнительный прием мелатонина может модулировать болевую реакцию. В условиях острой и воспалительной боли при активации рецепторов МТ1 и МТ2 уменьшается образование цАМФ и оказывается антиноцицептивный эффект на спинальном и супраспинальном уровнях [72]. За счет стимуляции секреции β-эндорфина, а также влияния на опиоидные, бензодиазепиновые, мускариновые и серотонинергические рецепторы в заднем роге спинного мозга мелатонин показал способность снижать интенсивность боли после операции. Пероральный прием 5 мг мелатонина за 1 час до операции на поясничных дисках способствовал уменьшению послеоперационной боли и количества принимаемых опиоидов [74]. Периферическое анальгетическое действие мелатонина опосредовано ингибированием липоксигеназы-5, циклооксигеназы ЦОГ-2 и NO-синтазы [75, 76].
Влияние мелатонина на хроническую боль опосредовано несколькими механизмами, главным из которых является подавление спинальной ноцицепции. Проникая через гематоэнцефалический барьер, мелатонин способен влиять на процессы центральной регуляции боли [77, 78]. Рецепторы мелатонина присутствуют в высокой концентрации в таламусе, гипоталамусе, задних рогах спинного мозга, спинномозговом пути тройничного нерва и ядре тройничного нерва, которые участвуют в ноцицептивной передаче. Предполагают, что центральные эффекты мелатонина включают облегчение ГАМК-ергической передачи путем модуляции ГАМК-рецепторов [79]. Известно, что сам мелатонин и его аналоги способны связываться с ГАМК-рецепторами. Кроме того, мелатонин также увеличивает концентрацию ГАМК на 50% [80].
Мелатонин оказывает антиноцицептивное действие в отношении невропатической боли [75]. Мелатонин способствует нормализации циркадных ритмов, нарушенных при хронической боли, благодаря чему происходит улучшение качества сна, уменьшение тревоги и активация собственных адаптивных возможностей организма.
Остеогенетические свойства мелатонина
Мелатонин оказывает влияние на костную ткань как за счет регуляции мембранных и ядерных рецепторов, так и за счет прямого антиоксидантного и противовоспалительного действий.
Мелатонин принимает участие в остео- и одонтогенезе, опосредуя свое действие преимущественно через ядерные рецепторы [81]. За счет активации RORα он стимулирует одонтогенную дифференцировку клеток зубных сосочков, а также регулирует образование и функцию митохондрий в этих клетках [82–84]. Мелатонин дозозависимо влияет на стволовые клетки пульпы зуба. В физиологических концентрациях он ингибирует пролиферацию, но способствует остеогенной дифференцировке и апоптозу стволовых клеток, реализует свое действие через сигнальный каскад Hippo [85–87]. В более высокой концентрации он способствует пролиферации и дифференцировке за счет подавления метилирования ДНК [88] и регуляции сигнальных путей ЦОГ-2/NF-κB и p38/ERK MAPK [89].
Мелатонин оказывает влияние на функцию остеобластов и остеокластов, одновременно подавляя потерю костной массы и способствуя образованию новой кости [90, 91]. Он стимулирует дифференцировку и активность остеобластов через сигнальный путь нейропептида Y (NPY/NPY1R), а также защищает клетки кости от повреждения свободными радикалами [92]. Мелатонин стимулирует образование коллагена I типа, основным компонентом органического матрикса кости, дентина и цемента зуба [93, 94]. Активируя рецептор MT2, мелатонин стимулирует экспрессию генов щелочной фосфатазы, костных морфогенетических белков BMP-2 и BMP-6, остеокальцина и остеопротегерина, тем самым способствуя образованию костной ткани. В остеобластах человека in vitro мелатонин обладает способностью стимулировать в микромолярных концентрациях пролиферацию и синтез коллагена типа I, других белков костного матрикса и костных маркеров (включая щелочную фосфатазу, остеопонтин и остеокальцин).
Известно, что лиганд-рецепторная система RANK/RANKL/OPG является ключевым звеном гомеостаза костной ткани, непосредственно регулирующим дифференцировку остеокластов и остеолиз. За счет ингибирования лиганда активатора рецептора ядерного фактора кВ (RANKL) мелатонин уменьшает образование и активацию остеокластов, а также подавляет остеолиз [90, 95, 96]. Антиоксидантное и противовоспалительное действие мелатонина также предотвращает резорбцию кости [97, 98].
Местное введение мелатонина увеличивало образование трабекулярной кости вблизи контакта с имплантатом у кроликов [99]. Точно так же у крыс лечение мелатонином, растворенным в питьевой воде, увеличивало объем кости, трабекулярную и кортикальную толщину бедренных костей и оказывало прямое стимулирующее действие мелатонина на дифференцировку и пролиферацию остеобластов [100].
В клинических исследованиях мелатонин показал способность положительно влиять на состояние костной ткани и улучшать остеоинтеграцию зубных имплантатов. Было проведено рандомизированное плацебо-контролируемое исследование по изучению влияния на костную ткань у женщин 56–73 лет с остеопенией. Мелатонин назначался в дозе 1 или 3 мг на ночь в течение одного года. Было обнаружено, что мелатонин дозозависимо увеличивает минеральную плотность кости шейки бедра: на 0,5% при приеме в дозе 1 мг/д и на 2,3% при приеме 3 мг/д. В группе, получавшей 3 мг мелатонина в день, наблюдалось увеличение толщины трабекул большеберцовой кости на 2,2% и объемной минеральной плотности костной ткани позвоночника на 3,6% [101].
Локальное нанесение 1,2 мг мелатонина в место остеотомии перед установкой импланта оказало положительное влияние на состояния костной ткани: значительно меньшее снижение высоты проксимальной кости и толщины кортикальной пластины вокруг имплантата через 6 месяцев [102]. Промывание места остеотомии с помощью раствора, содержавшего 3 мг мелатонина, перед установкой импланта также улучшало исход у пациентов через 3 месяца. У пациентов наблюдалось снижение потери костной ткани альвеолярного гребня и повышение стабильности имплантата по сравнению с ирригацией физраствором [103].
Клинические исследования применения мелатонина при заболеваниях пародонта
Стандартный протокол лечения при заболеваниях пародонта включает механическую обработку поверхностей зубов и противомикробную медикаментозную терапию с целью удаления зубного камня и биопленки. Однако антибиотикорезистентность микроорганизмов – явление не редкое и требующее коррекции терапевтического подхода. Кроме того, известно, что после процедуры снятия поддесневых зубных отложений (Scaling and Root Planing – SRP) реколонизация микроорганизмов происходит примерно через 3 месяца [104], и при повторных курсах терапии могут возникать проблемы с подбором эффективных противомикробных препаратов. Дополнительное назначение мелатонина может оказаться полезным профилактическим и терапевтическим способом оптимизации схемы терапии.
В метаанализе, объединившем результаты 7 рандомизированных клинических исследований с участием 412 человек, было показано, что дополнительный прием мелатонина может значительно улучшить состояние пародонта при нехирургическом лечении. Продолжительность назначения мелатонина варьировалась от 4 недель до 6 месяцев. Включение мелатонина в программу терапии уменьшало глубину пародонтальных карманов в среднем на 1,18 мм (95% ДИ -1,75; -0,62, I2 = 85,7%), величину индекса Clinical Attachment Loss (CAL) – на 1,16 мм (95% ДИ -1,60; -0,72, I2 = 76,7%] и десневого индекса GI (gingival index) – на 0,29 (95% ДИ -0,48; -0,11, I2 = 63,6%) по сравнению с традиционной нехирургической терапией. Эффект был дозозависим: более высокие дозы мелатонина (3–10 мг) сильнее влияли на глубину пародонтальных карманов [WMD = -1,32, 95% ДИ (-2,31, -0,15) I2 = 93%] и индекс CAL [WMD = -1,30 , 95% ДИ (-1,80, -0,81) I2= 73,7%] по сравнению с более низкими дозами (< 3 мг мелатонина) [68]. Ранее в метаанализе, проведенном Balaji TM. с соавт., было показано, что при приеме 1–2 мг мелатонина наблюдается уменьшение глубины пародонтальных карманов, но оно статистически недостоверно [105].
Необходимо отметить, что мелатонин очень быстро начинает оказывать положительное влияние на состояние пародонта: уменьшение глубины пародонтальных карманов, десневого индекса, индексов зубного налета и CAL наблюдалось уже через 20 дней приема мелатонина [106].
В проведенных исследованиях показали эффективность различные формы мелатонина – пероральные таблетки и капсулы, а также наносимый местно 5% гель мелатонина. В исследованиях Cutando A. у пациентов с пародонтитом и СД на протяжении 20 дней применялся 1% крем мелатонина на основе орабейз (Orabase). Наряду с клинической эффективностью он продемонстрировал улучшение лабораторных показателей: значительное снижение концентрации СРБ и ИЛ-6 в сыворотке крови, а также повышение остеопротегрина и снижение кислой и щелочной фосфатазы, остеопонтина, остеокальцина и RANKL в слюне [107–109]. Вместе с тем полоскание рта раствором, содержащим мелатонин, ежевечерне в течение двух недель не влияло на состояние пародонта [110]. Таким образом, при выборе препарата необходимо учитывать его форму.
Экзогенный мелатонина характеризуется низкой биодоступностью: по данным исследований усваивается в среднем 15% (от 1 до 37%) поступившего мелатонина. Считается, что максимальная концентрация мелатонина регистрируется в крови через 50 минут после перорального приема и T1/2 составляет 45 мин. [111]. У женщин биодоступность выше, чем у мужчин – 16,8% против 8,6% [11]. На фармакокинетику препаратов мелатонина также оказывают влияние возраст, курение, употребление кофеина, режим питания и некоторые лекарственные препараты (флувоксамин, оральные контрацептивы) [111]. Учитывая низкую биодоступность и значительное разрушение экзогенного мелатонина при первичном пассаже через печень, для профилактики и лечения заболеваний полости рта целесообразно использовать местные формы мелатонина. Внимания заслуживают сублингвальные препараты, из которых мелатонин усваивается более полно, чем из пероральных форм. Было показано, что при сублингвальном применении биодоступность мелатонина в 1,86 раза превышает таковую пероральных форм [112]. Эффективность сублингвальных таблеток была показана в ряде исследований, где мелатонин применялся в качестве препарата премедикации: он оказывал анксиолитическое действие и снижал интенсивность боли в послеоперационном периоде [113, 114].
Противовоспалительное действие мелатонина было доказано в исследовании, включавшем пациентов с хроническим периодонтитом и первичной бессонницей, получавших SRP терапию. Через 3 и 6 месяцев приема мелатонина наряду с улучшением пародонтальных индексов и качества сна у них наблюдалось статистически значимое снижение концентрации ФНО-α в слюне по сравнению с плацебо [115].
У пациентов c СД 2 типа, получающих нехирургическую пародонтальную терапию, мелатонин помимо улучшения состояния пародонта может способствовать снижению концентрации гликированного гемоглобина HbA1c [116]. Результаты этого метанализа подтверждаются данными обзора Delpino FM (2021), в котором в 56% из 16 исследований наблюдалось улучшение показателей углеводного обмена у пациентов СД 2 типа на фоне приема мелатонина. Мелатонин способствовал снижению концентрации глюкозы натощак, HbA1c и инсулинорезистеентности [117].
Представляют интерес потенциальные комбинации мелатонина с другими веществами, проявляющими антиоксидантные, противовоспалительные и антимикробные свойства, а также влияющими на обмен в костной ткани. Добавление к мелатонину витамина С в дозе 60 мг/д повышало эффективность антиоксидантной терапии и оказывало более выраженный положительный эффект на состояние пародонта. Витамин С обеспечивает восстановление окисленного мелатонина, а также принимает участие в регенерации тканей и регуляции антимикробной защиты [118].
Еще одной интересной комбинацией является сочетание мелатонина с глицином. Известно, что связочный аппарат периодонта и основную массу свободной части десны составляют коллагеновые волокна [119]. Глицин входит в состав коллагена и других белков межклеточного матрикса, играя роль регулятора обмена веществ [120]. Кроме того, глицин содержится в составе белков зубной эмали [121].
Одновременно с этим, глицин является одним из основных тормозных нейромедиаторов. Он, как правило, уравновешивает системы возбуждения и торможения в ЦНС, способствует уменьшению реакции на воздействие стрессоров [122]. Выявлено, что одним из факторов развития воспалительных заболеваний пародонта у молодых лиц является дезадаптация к хроническому психоэмоциональному напряжению. В состоянии эмоционального стресса меняются привычки людей, появляются расстройства сна. Это значительно ослабляет защитные силы организма и способствует развитию воспаления [123]. Прием глицина перед сном способствует улучшению качества сна [124].
При совместном приеме глицин и мелатонин дополняют действие друг друга, их комбинация потенцирует эффекты обоих веществ при нарушениях сна. Она сокращает время засыпания, субъективно улучшает качество сна (без влияния на его архитектуру), уменьшает сонливость и усталость в течение дня у пациентов, страдающих бессонницей или со сниженной продолжительностью сна, в том числе на фоне соматических заболеваний, снижает уровень тревожности и повышает работоспособность [125].
Существуют лекарственные средства на основе фиксированной комбинации глицина и мелатонина в форме таблеток подъязычных [125]. Такая форма представляет особый интерес при патологии пародонта, поскольку абсорбция активных веществ осуществляется в непосредственной близости от патологического очага. Принимать комплекс глицина и мелатонина в форме подъязычных таблеток можно непосредственно перед сном [125], а не за 30–40 минут до сна, как мелатонин в таблетках, покрытых пленочной оболочкой [126].
Заключение
Таким образом, мелатонин является не только гормоном, регулирующим цикл «сон–бодрствование», но и важным антиоксидантным, противовоспалительным и антимикробным фактором в организме человека. Имеющиеся данные указывают на то, что он может быть использован в качестве биомаркера и вспомогательного лечебного фактора при заболеваниях пародонта. Из-за низкого содержания мелатонина в продуктах питания удовлетворить потребность в нем только за счет натуральных продуктов не представляется возможным. Для профилактики и лечения заболеваний пародонта целесообразно использовать сублингвальные и пероральные формы препаратов мелатонина с высокой биодоступностью. Эффективность мелатонина в лечении хронических заболеваний пародонта зависит от формы, дозы и, вероятно, длительности применения препарата. Учитывая влияние мелатонина на углеводный обмен, системное воспаление и оксидативный стресс, его прием особенно показан пациентам с хроническими неинфекционными заболеваниями, такими как СД 2 типа. Остается открытым вопрос о возможности создания комплексных препаратов мелатонина с витаминами, аминокислотами и другими веществами, влияющими на воспаление, микробиом и обмен веществ в тканях десны. Таким синергистом является глицин, выполняющий как структурную, так и регуляторную функцию. Он входит в состав белков соединительной ткани, регулирует обмен веществ, способствует нормализации процессов возбуждения и торможения в ЦНС, уменьшению стрессовой реакции и улучшению сна. Для определения оптимальной формы и режима дозирования необходимы дальнейшие долгосрочные клинические исследования.
Список литературы /References
1. Global oral health status report: towards universal health coverage for oral health by 2030. Geneva: World Health Organization; 2022. Licence: CC BY-NC-SA 3.0 IGO.
2. Listl S, Galloway J, Mossey PA, Marcenes W. Global Economic Impact of Dental Diseases. J Dent Res. 2015 Oct;94(10):1355-61. doi: 10.1177/0022034515602879.
3. Taubman MA, Valverde P, Han X, Kawai T. Immune Response: The Key to Bone Resorption in Periodontal Disease. J Periodontol. 2005 Nov;76 Suppl 11S:2033-2041. doi: 10.1902/jop.2005.76.11-S.2033.
4. Lerner, Aaron Bunsen, James D. Case, Yoshiyata Takahashi, Teh H. Lee and Wataru Mori. Isolation of melatonin, the pineal gland factor that lightens melanocytes. Journal of the American Chemical Society 80 (1958): 2587-2587.
5. Arendt J. Melatonin: characteristics, concerns, and prospects. J Biol Rhythms. 2005 Aug;20(4):291-303. doi: 10.1177/0748730405277492.
6. Hardeland R, Pandi-Perumal SR, Cardinali DP. Melatonin. Int J Biochem Cell Biol. 2006 Mar;38(3):313-6. doi: 10.1016/j.biocel.2005.08.020.
7. Axelrod J. The pineal gland: A neurochemical transducer. Science. 1974;184:1341–1348. doi: 10.1126/science.184.4144.1341.
8. Reiter R.J. Pineal melatonin: Cell biology of its synthesis and of its physiological interactions. Endocr. Rev. 1991;12:151–180. doi: 10.1210/edrv-12-2-151.
9. Acuña-Castroviejo D, Escames G, Venegas C, Díaz-Casado ME, Lima-Cabello E, López LC, Rosales-Corral S, Tan DX, Reiter RJ. Extrapineal melatonin: sources, regulation, and potential functions. Cell Mol Life Sci. 2014 Aug;71(16):2997-3025. doi: 10.1007/s00018-014-1579-2.
10. Iesanu MI, Zahiu CDM, Dogaru IA, Chitimus DM, Pircalabioru GG, Voiculescu SE, Isac S, Galos F, Pavel B, O’Mahony SM, Zagrean AM. Melatonin-Microbiome Two-Sided Interaction in Dysbiosis-Associated Conditions. Antioxidants (Basel). 2022 Nov 14;11(11):2244. doi: 10.3390/antiox11112244.
11. Meng X, Li Y, Li S, Zhou Y, Gan RY, Xu DP, Li HB. Dietary Sources and Bioactivities of Melatonin. Nutrients. 2017 Apr 7;9(4):367. doi: 10.3390/nu9040367.
12. Arnao MB, Hernández-Ruiz J. The Potential of Phytomelatonin as a Nutraceutical. Molecules. 2018 Jan 22;23(1):238. doi: 10.3390/molecules23010238.
13. Nøddegaard F, Kennaway DJ. A method of achieving physiological plasma levels of melatonin in the chicken by oral administration. J Pineal Res. 1999 Oct;27(3):129-38. doi: 10.1111/j.1600-079x.1999.tb00607.x.
14. Reiter RJ, Tan DX, Manchester LC, Simopoulos AP, Maldonado MD, Flores LJ, Terron MP. Melatonin in edible plants (phytomelatonin): Identification, concentrations, bioavailability and proposed functions. World Rev Nutr Diet. 2007;97:211-230. doi: 10.1159/000097917.
15. Sae-Teaw M, Johns J, Johns NP, Subongkot S. Serum melatonin levels and antioxidant capacities after consumption of pineapple, orange, or banana by healthy male volunteers. J Pineal Res. 2013 Aug;55(1):58-64. doi: 10.1111/jpi.12025.
16. Pereira GA, Gomes Domingos AL, Aguiar AS. Relationship between food consumption and improvements in circulating melatonin in humans: an integrative review. Crit Rev Food Sci Nutr. 2022;62(3):670-678. doi: 10.1080/10408398.2020.1825924.
17. Nagata C, Wada K, Yamakawa M, Nakashima Y, Koda S, Uji T, Onuma S, Oba S, Maruyama Y, Hattori A. Associations Between Dietary Melatonin Intake and Total and Cause-Specific Mortality Among Japanese Adults in the Takayama Study. Am J Epidemiol. 2021 Dec 1;190(12):2639-2646. doi: 10.1093/aje/kwab213.
18. Rzepka-Migut B, Paprocka J. Melatonin-Measurement Methods and the Factors Modifying the Results. A Systematic Review of the Literature. Int J Environ Res Public Health. 2020 Mar 15;17(6):1916. doi: 10.3390/ijerph17061916.
19. Okatani Y., Okamoto K., Hayashi K., Wakatsuki A., Sagara Y. Maternal-fetal transfer of melatonin in human pregnancy near term. J. Pineal Res. 1998;25:129–134. doi: 10.1111/j.1600-079X.1998.tb00550.x.
20. Tan DX, Manchester LC, Hardeland R, Lopez-Burillo S, Mayo JC, Sainz RM, Reiter RJ. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin. J Pineal Res. 2003 Jan;34(1):75-8. doi: 10.1034/j.1600-079x.2003.02111.x.
21. Meenakshi SS, Malaiappan S. Role of melatonin in periodontal disease - A systematic review. Indian J Dent Res. 2020 Jul-Aug;31(4):593-600. doi: 10.4103/ijdr. IJDR_227_18.
22. Emet M, Ozcan H, Ozel L, Yayla M, Halici Z, Hacimuftuoglu A. A Review of Melatonin, Its Receptors and Drugs. Eurasian J Med. 2016 Jun;48(2):135-41. doi: 10.5152/eurasianjmed.2015.0267.
23. Liu J, Clough SJ, Hutchinson AJ, Adamah-Biassi EB, Popovska-Gorevski M, Dubocovich ML. MT1 and MT2 Melatonin Receptors: A Therapeutic Perspective. Annu Rev Pharmacol Toxicol. 2016;56:361-83. doi: 10.1146/annurev-pharmtox-010814-124742.
24. Legros C, Dupuis P, Ferry G, Boutin JA. Measuring Binding at the Putative Melatonin Receptor MT3. Methods Mol Biol. 2022;2550:283-289. doi: 10.1007/978-1-0716-2593-4_30.
25. Laakso M.L., Porkka-Heiskanen T., Alila A., Stenberg D., Johansson G. Correlation between salivary and serum melatonin: Dependence on serum melatonin levels. J. Pineal Res. 1990;9:39–50. doi: 10.1111/j.1600-079X.1990.tb00692.x.
26. Shimozuma, M., Tokuyama, R., Tatehara, S. et al. Expression and cellular localization of melatonin-synthesizing enzymes in rat and human salivary glands. Histochem Cell Biol 135, 389–396 (2011). https://doi.org/10.1007/s00418-011-0800-8.
27. Kara A, Akman S, Ozkanlar S, Tozoglu U, Kalkan Y, Canakci CF, Tozoglu S. Immune modulatory and antioxidant effects of melatonin in experimental periodontitis in rats. Free Radic Biol Med. 2013 Feb;55:21-6. doi: 10.1016/j.freeradbiomed. 2012.11.002.
28. Srinath R, Acharya AB, Thakur SL. Salivary and gingival crevicular fluid melatonin in periodontal health and disease. J Periodontol. 2010 Feb;81(2):277-83. doi: 10.1902/jop.2009.090327.
29. Almughrabi OM, Marzouk KM, Hasanato RM, Shafik SS. Melatonin levels in periodontal health and disease. J Periodontal Res. 2013 Jun;48(3):315-21. doi: 10.1111/jre.12010.
30. Balaji TM, Vasanthi HR, Rao SR. Gingival, plasma and salivary levels of melatonin in periodontally healthy individuals and chronic periodontitis patients: a pilot study. J Clin Diagn Res. 2015 Mar;9(3):ZC23-5. doi: 10.7860/JCDR/2015/11311.5652.
31. Ghallab NA, Hamdy E, Shaker OG. Malondialdehyde, superoxide dismutase and melatonin levels in gingival crevicular fluid of aggressive and chronic periodontitis patients. Aust Dent J. 2016 Mar;61(1):53-61. doi: 10.1111/adj.12294.
32. Balaji TM, Varadarajan S, Jagannathan R, Gupta AA, Raj AT, Patil S, Fageeh HI, Fageeh HN. Melatonin levels in periodontitis vs. the healthy state: A systematic review and meta-analysis. Oral Dis. 2022 Mar;28(2):284-306. doi: 10.1111/ odi.13679.
33. Bertl K, Schoiber A, Haririan H, Laky M, Steiner I, Rausch WD, Andrukhov O, Rausch-Fan X. Non-surgical periodontal therapy influences salivary melatonin levels. Clin Oral Investig. 2013 May;17(4):1219-25. doi: 10.1007/s00784-012-0801-6.
34. He F, Wu X, Zhang Q, Li Y, Ye Y, Li P, Chen S, Peng Y, Hardeland R, Xia Y. Bacteriostatic Potential of Melatonin: Therapeutic Standing and Mechanistic Insights. Front Immunol. 2021 May 31;12:683879. doi: 10.3389/fimmu.2021.683879.
35. Tekbas OF, Ogur R, Korkmaz A, Kilic A, Reiter RJ. Melatonin as an antibiotic: new insights into the actions of this ubiquitous molecule. J Pineal Res. 2008 Mar;44(2):222-6. doi: 10.1111/j.1600-079X.2007.00516.x.
36. Bishayi B, Adhikary R, Nandi A, Sultana S. Beneficial Effects of Exogenous Melatonin in Acute Staphylococcus aureus and Escherichia coli Infection-Induced Inflammation and Associated Behavioral Response in Mice After Exposure to Short Photoperiod. Inflammation. 2016 Dec;39(6):2072-2093. doi: 10.1007/s10753-016-0445-9.
37. Celinski, K.; Konturek, P.C.; Konturek, S.J.; Slomka, M.; Cichoz-Lach, H.; Brzozowski, T.; Bielanski, W. Effects of melatonin and tryptophan on healing of gastric and duodenal ulcers with Helicobacter pylori infection in humans. J. Physiol. Pharmacol. 2011, 62, 521–526.
38. Zhou W, Zhang X, Zhu CL, He ZY, Liang JP, Song ZC. Melatonin Receptor Agonists as the «Perioceutics» Agents for Periodontal Disease through Modulation of Porphyromonas gingivalis Virulence and Inflammatory Response. PLoS One. 2016 Nov 10;11(11):e0166442. doi: 10.1371/journal.pone.0166442.
39. Choi EY, Jin JY, Lee JY, Choi JI, Choi IS, Kim SJ. Melatonin inhibits Prevotella intermedia lipopolysaccharide-induced production of nitric oxide and interleukin-6 in murine macrophages by suppressing NF-κB and STAT1 activity. J Pineal Res. 2011 Mar;50(2):197-206. doi: 10.1111/j.1600-079X.2010.00829.x.
40. Zheng S, Yu S, Fan X, Zhang Y, Sun Y, Lin L, Wang H, Pan Y, Li C. Porphyromonas gingivalis survival skills: Immune evasion. J Periodontal Res. 2021 Dec;56(6):1007-1018. doi: 10.1111/jre.12915.
41. Wang C, Li X, Cheng T, Wang L, Jin L. RNA Sequencing Reveals the Upregulation of FOXO Signaling Pathway in Porphyromonas gingivalis Persister-Treated Human Gingival Epithelial Cells. Int J Mol Sci. 2022 May 20;23(10):5728. doi: 10.3390/ijms23105728.
42. Tsai CC, Chen HS, Chen SL, Ho YP, Ho KY, Wu YM, Hung CC. Lipid peroxidation: a possible role in the induction and progression of chronic periodontitis. J Periodontal Res. 2005 Oct;40(5):378-84. doi: 10.1111/j.1600-0765.2005.00818.x.
43. Sczepanik FSC, Grossi ML, Casati M, Goldberg M, Glogauer M, Fine N, Tenenbaum HC. Periodontitis is an inflammatory disease of oxidative stress: We should treat it that way. Periodontol 2000. 2020 Oct;84(1):45-68. doi: 10.1111/prd.12342.
44. Cutando A, Gómez-Moreno G, Villalba J, Ferrera MJ, Escames G, Acuña-Castroviejo D. Relationship between salivary melatonin levels and periodontal status in diabetic patients. J Pineal Res. 2003 Nov;35(4):239-44. doi: 10.1034/j.1600-079x.2003.00075.x.
45. Chen M, Cai W, Zhao S, Shi L, Chen Y, Li X, Sun X, Mao Y, He B, Hou Y, Zhou Y, Zhou Q, Ma J, Huang S. Oxidative stress-related biomarkers in saliva and gingival crevicular fluid associated with chronic periodontitis: A systematic review and meta-analysis. J Clin Periodontol. 2019 Jun;46(6):608-622. doi: 10.1111/jcpe.13112.
46. Gitto E, Pellegrino S, Gitto P, Barberi I, Reiter RJ. Oxidative stress of the newborn in the pre- and postnatal period and the clinical utility of melatonin. J Pineal Res. 2009 Mar;46(2):128-39. doi: 10.1111/j.1600-079X.2008.00649.x.
47. Reiter RJ, Mayo JC, Tan DX, Sainz RM, Alatorre-Jimenez M, Qin L. Melatonin as an antioxidant: under promises but over delivers. J Pineal Res. 2016 Oct;61(3):253-78. doi: 10.1111/jpi.12360.
48. Ramis MR, Esteban S, Miralles A, Tan DX, Reiter RJ. Protective Effects of Melatonin and Mitochondria-targeted Antioxidants Against Oxidative Stress: A Review. Curr Med Chem. 2015;22(22):2690-711. doi: 10.2174/0929867322666150619104143.
49. Pieri C, Marra M, Moroni F, Recchioni R, Marcheselli F. Melatonin: a peroxyl radical scavenger more effective than vitamin E. Life Sci. 1994;55(15):PL271-6. doi: 10.1016/0024-3205(94)00666-0.
50. Minich DM, Henning M, Darley C, Fahoum M, Schuler CB, Frame J. Is Melatonin the «Next Vitamin D»?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients. 2022 Sep 22;14(19):3934. doi: 10.3390/nu14193934.
51. Chitimus DM, Popescu MR, Voiculescu SE, Panaitescu AM, Pavel B, Zagrean L, Zagrean AM. Melatonin’s Impact on Antioxidative and Anti-Inflammatory Reprogramming in Homeostasis and Disease. Biomolecules. 2020 Aug 20;10(9):1211. doi: 10.3390/biom10091211.
52. Dehdari Ebrahimi N, Parsa S, Nozari F, Shahlaee MA, Maktabi A, Sayadi M, Sadeghi A, Azarpira N. Protective effects of melatonin against the toxic effects of environmental pollutants and heavy metals on testicular tissue: A systematic review and meta-analysis of animal studies. Front Endocrinol (Lausanne). 2023 Jan 30;14:1119553. doi: 10.3389/fendo.2023.1119553.
53. Nuszkiewicz J, Woźniak A, Szewczyk-Golec K. Ionizing Radiation as a Source of Oxidative Stress-The Protective Role of Melatonin and Vitamin D. Int J Mol Sci. 2020 Aug 13;21(16):5804. doi: 10.3390/ijms21165804.
54. Blasiak J, Kasznicki J, Drzewoski J, Pawlowska E, Szczepanska J, Reiter RJ. Perspectives on the use of melatonin to reduce cytotoxic and genotoxic effects of methacrylate-based dental materials. J Pineal Res. 2011 Sep;51(2):157-62. doi: 10.1111/j.1600-079X.2011.00877.x.
55. Gautam R, Singh RD, Sharma VP, Siddhartha R, Chand P, Kumar R. Biocompatibility of polymethylmethacrylate resins used in dentistry. J Biomed Mater Res B Appl Biomater. 2012 Jul;100(5):1444-50. doi: 10.1002/jbm.b.32673.
56. Cutando A, Arana C, Gómez-Moreno G, Escames G, López A, Ferrera MJ, Reiter RJ, Acuña-Castroviejo D. Local application of melatonin into alveolar sockets of beagle dogs reduces tooth removal-induced oxidative stress. J Periodontol. 2007 Mar;78(3):576-83. doi: 10.1902/jop.2007.060244.
57. Sedghi LM, Bacino M, Kapila YL. Periodontal Disease: The Good, The Bad, and The Unknown. Front Cell Infect Microbiol. 2021 Dec 7;11:766944. doi: 10.3389/fcimb.2021.766944.
58. Sørensen HT, Mellemkjaer L, Blot WJ, Nielsen GL, Steffensen FH, McLaughlin JK, Olsen JH. Risk of upper gastrointestinal bleeding associated with use of lowdose aspirin. Am J Gastroenterol. 2000 Sep;95(9):2218-24. doi: 10.1111/j.1572-0241.2000.02248.x.
59. Chalitsios CV, Shaw DE, McKeever TM. Corticosteroids and bone health in people with asthma: A systematic review and meta-analysis. Respir Med. 2021 May;181:106374. doi: 10.1016/j.rmed.2021.106374.
60. Cho JH, Bhutani S, Kim CH, Irwin MR. Anti-inflammatory effects of melatonin: A systematic review and meta-analysis of clinical trials. Brain Behav Immun. 2021 Mar;93:245-253. doi: 10.1016/j.bbi.2021.01.034.
61. De Colli M, Tortorella P, Agamennone M, Campestre C, Loiodice F, Cataldi A, Zara S. Bisphosfonate matrix metalloproteinase inhibitors for the treatment of periodontitis: An in vitro study. Int J Mol Med. 2018 Jul;42(1):651-657. doi: 10.3892/ijmm.2018.3641.
62. Черемных, А. И. Антиоксидантная активность мелатонина в плости рта при гингивите и пародонтите / А. И. Черемных // Международный студенческий научный вестник. – 2019. – № 5-1. – С. 10. – EDN GATPWL. Cheremnykh A.I. Antioxidant activity of melatonin in the oral cavity with gingivitis and periodontitis. International Student Scientific Magazine. – 2019. – № 5 (part 1) – P. 13-13. https://eduherald.ru/ru/article/view?id=19736
63. de la Rocha N, Rotelli A, Aguilar CF, Pelzer L. Structural basis of the anti-inflammatory activity of melatonin. Arzneimittelforschung. 2007;57(12):782-6. doi: 10.1055/s-0031-1296680.
64. Bilici D, Akpinar E, Kiziltunç A. Protective effect of melatonin in carrageenan-induced acute local inflammation. Pharmacol Res. 2002 Aug;46(2):133-9. doi: 10.1016/s1043-6618(02)00089-0.
65. Renn TY, Huang YK, Feng SW, Wang HW, Lee WF, Lin CT, Burnouf T, Chen LY, Kao PF, Chang HM. Prophylactic supplement with melatonin successfully suppresses the pathogenesis of periodontitis through normalizing RANKL/OPG ratio and depressing the TLR4/MyD88 signaling pathway. J Pineal Res. 2018 Apr;64(3). doi: 10.1111/jpi.12464.
66. Hosokawa I, Hosokawa Y, Shindo S, Ozaki K, Matsuo T. Melatonin Inhibits CXCL10 and MMP-1 Production in IL-1β-Stimulated Human Periodontal Ligament Cells. Inflammation. 2016 Aug;39(4):1520-6. doi: 10.1007/s10753-016-0386-3.
67. Честных Е.В., Карташева Ю.Н., Захарова Е.С., Леонтьева Е.В. Мелатонин в стоматологической практике: Возможности и перспективы применения (обзор литературы). Верхневолжский медицинский журнал. – 2019. – Т. 18, № 2. – С. 27-30. Chestnyh E.V., Kartasheva Yu.N., Zakharova E.S., Leontyeva E.V. Melatonin in dental practice: applications and prospects (literature review). Upper Volga Medical Journal. – 2019. – 18(2). – 27-30.
68. Liu RY, Li L, Zhang ZT, Wu T, Lin S, Zhang XT. Clinical efficacy of melatonin as adjunctive therapy to non-surgical treatment of periodontitis: a systematic review and meta-analysis. Inflammopharmacology. 2022 Jun;30(3):695-704. doi: 10.1007/s10787-022-00959-3.
69. Marani, F., Santos, R. M., Mattera, M. S. L. C., Tsosura, T. V. S., Pereira, R. F., Ueno, M. J. P., Sumida, D. H. (2021). Supplementation with melatonin prevents alveolar bone resorption in rats with periodontal disease and pinealectomy. Journal of the International Academy of Periodontology, 2021;23(3):211–223.
70. Morris RW, Lutsch EF. Daily susceptibility rhythm to morphine analgesia. J Pharm Sci. 1969 Mar;58(3):374-6. doi: 10.1002/jps.2600580324.
71. Kurdi MS, Patel T. The role of melatonin in anaesthesia and critical care. Indian J Anaesth. 2013 Mar;57(2):137-44. doi: 10.4103/0019-5049.111837.
72. Wilhelmsen M, Amirian I, Reiter RJ, Rosenberg J, Gögenur I. Analgesic effects of melatonin: a review of current evidence from experimental and clinical studies. J Pineal Res. 2011 Oct;51(3):270-7. doi: 10.1111/j.1600-079X.2011.00895.x.
73. Nelson FA, Farr LA, Ebadi M. Salivary melatonin response to acute pain stimuli. J Pineal Res. 2001 May;30(4):206-12. doi: 10.1034/j.1600-079x.2001.300403.x.
74. Baradari AG, Habibi MR, Aarabi M, Sobhani S, Babaei A, Zeydi AE, Ghayoumi F. The Effect of Preoperative Oral Melatonin on Postoperative Pain after Lumbar Disc Surgery: A Double-Blinded Randomized Clinical Trial. Ethiop J Health Sci. 2022 Nov;32(6):1193-1202. doi: 10.4314/ejhs.v32i6.17.
75. Ambriz-Tututi M, Rocha-González HI, Cruz SL, Granados-Soto V. Melatonin: a hormone that modulates pain. Life Sci. 2009 Apr 10;84(15-16):489-98. doi: 10.1016/j.lfs.2009.01.024.
76. Mayo JC, Sainz RM, Tan DX, Hardeland R, Leon J, Rodriguez C, Reiter RJ. Anti-inflammatory actions of melatonin and its metabolites, N1-acetyl-N2-formyl-5-methoxykynuramine (AFMK) and N1-acetyl-5-methoxykynuramine (AMK), in macrophages. J Neuroimmunol. 2005 Aug;165(1-2):139-49. doi: 10.1016/j.jneuroim.2005.05.002.
77. De Gregorio D, Comai S. Acute and Chronic Pain Preclinical Models to Study the Analgesic Properties of Melatonergic Compounds. Methods Mol Biol. 2022;2550:453-461. doi: 10.1007/978-1-0716-2593-4_44.
78. Zahn PK, Lansmann T, Berger E, Speckmann EJ, Musshoff U. Gene expression and functional characterization of melatonin receptors in the spinal cord of the rat: implications for pain modulation. J Pineal Res. 2003 Aug;35(1):24-31. doi: 10.1034/j.1600-079x.2003.00047.x.
79. Coloma FM, Niles LP. Melatonin enhancement of [3H]-gamma-aminobutyric acid and [3H]muscimol binding in rat brain. Biochem Pharmacol. 1988 Apr 1;37(7):1271-4. doi: 10.1016/0006-2952(88)90781-2.
80. Xu F, Li JC, Ma KC, Wang M. Effects of melatonin on hypothalamic gamma-aminobutyric acid, aspartic acid, glutamic acid, beta-endorphin and serotonin levels in male mice. Biol Signals. 1995 Jul-Aug;4(4):225-31. doi: 10.1159/000109446.
81. Kang J, Chen H, Zhang F, Yan T, Fan W, Jiang L, He H, Huang F. RORα Regulates Odontoblastic Differentiation and Mediates the Pro-Odontogenic Effect of Melatonin on Dental Papilla Cells. Molecules. 2021 Feb 19;26(4):1098. doi: 10.3390/ molecules26041098.
82. Tachibana R., Tatehara S., Kumasaka S., Tokuyama R., Satomura K. Effect of melatonin on human dental papilla cells. Int. J. Mol. Sci. 2014;15:17304–17317. doi: 10.3390/ijms151017304.
83. Jiang LL, Zhang FP, He YF, Fan WG, Zheng MM, Kang J, Huang F, He HW. Melatonin regulates mitochondrial function and biogenesis during rat dental papilla cell differentiation. Eur Rev Med Pharmacol Sci. 2019 Jul;23(13):5967-5979. doi: 10.26355/eurrev_201907_18343.
84. Kumasaka S, Shimozuma M, Kawamoto T, Mishima K, Tokuyama R, Kamiya Y, Davaadorj P, Saito I, Satomura K. Possible involvement of melatonin in tooth development: expression of melatonin 1a receptor in human and mouse tooth germs. Histochem Cell Biol. 2010 May;133(5):577-84. doi: 10.1007/s00418-010- 0698-6.
85. Baysal E, Zırh EB, Buber E, Jakobsen TK, Zeybek ND. The effect of melatonin on Hippo signaling pathway in dental pulp stem cells. Neurochem Int. 2021 Sep;148:105079. doi: 10.1016/j.neuint.2021.105079.
86. Deng Q, Liu Q, Zhang H, Fan W, Li J, Kang J, He H, Huang F. Melatonin enhances hydrogen peroxide-induced apoptosis in human dental pulp cells. J Dent Sci. 2019 Dec;14(4):370-377. doi: 10.1016/j.jds.2019.05.003.
87. Liu Q, Fan W, He Y, Zhang F, Guan X, Deng Q, Lu X, He H, Huang F. Effects of melatonin on the proliferation and differentiation of human dental pulp cells. Arch Oral Biol. 2017 Nov;83:33-39. doi: 10.1016/j.archoralbio.2017.06.034.
88. Li J., Deng Q., Fan W., Zeng Q., He H., Huang F. Melatonin-induced suppression of DNA methylation promotes odontogenic differentiation in human dental pulp cells. Bioengineered. 2020;11:829–840. doi: 10.1080/21655979.2020.1795425.
89. Chan YH, Ho KN, Lee YC, Chou MJ, Lew WZ, Huang HM, Lai PC, Feng SW. Melatonin enhances osteogenic differentiation of dental pulp mesenchymal stem cells by regulating MAPK pathways and promotes the efficiency of bone regeneration in calvarial bone defects. Stem Cell Res Ther. 2022 Feb 19;13(1):73. doi: 10.1186/s13287-022-02744-z.
90. Li T, Jiang S, Lu C, Yang W, Yang Z, Hu W, Xin Z, Yang Y. Melatonin: Another avenue for treating osteoporosis? J Pineal Res. 2019 Mar;66(2):e12548. doi: 10.1111/jpi.12548.
91. Witt-Enderby PA, Radio NM, Doctor JS, Davis VL. Therapeutic treatments potentially mediated by melatonin receptors: potential clinical uses in the prevention of osteoporosis, cancer and as an adjuvant therapy. J Pineal Res. 2006 Nov;41(4):297-305. doi: 10.1111/j.1600-079X.2006.00369.x.
92. López-Martínez F., Olivares Ponce P.N., Guerra Rodríguez M., Martínez Pedraza R. Melatonin: Bone metabolism in oral cavity. Int. J. Dent. 2012;2012:628406. doi: 10.1155/2012/628406.
93. Cutando A, Gómez-Moreno G, Arana C, Acuña-Castroviejo D, Reiter RJ. Melatonin: potential functions in the oral cavity. J Periodontol. 2007 Jun;78(6):1094-102. doi: 10.1902/jop.2007.060396.
94. Nakade O., Koyama H., Ariji H., Yajima A., Kaku T. Melatonin stimulates proliferation and type I collagen synthesis in human bone cells in vitro. J. Pineal Res. 1999;27:106–110. doi: 10.1111/j.1600-079X.1999.tb00603.x.
95. Koyama H, Nakade O, Takada Y, Kaku T, Lau KH. Melatonin at pharmacologic doses increases bone mass by suppressing resorption through down-regulation of the RANKL-mediated osteoclast formation and activation. J Bone Miner Res. 2002 Jul;17(7):1219-29. doi: 10.1359/jbmr.2002.17.7.1219.
96. Cutando A, Aneiros-Fernández J, López-Valverde A, Arias-Santiago S, Aneiros-Cachaza J, Reiter RJ. A new perspective in Oral health: potential importance and actions of melatonin receptors MT1, MT2, MT3, and RZR/ROR in the oral cavity. Arch Oral Biol. 2011 Oct;56(10):944-50. doi: 10.1016/j.archoralbio.2011.03.004
97. Duan Y, Liang Y, Yang F, Ma Y. Neural Regulations in Tooth Development and Tooth-Periodontium Complex Homeostasis: A Literature Review. Int J Mol Sci. 2022 Nov 16;23(22):14150. doi: 10.3390/ijms232214150.
98. Cardinali DP, Ladizesky MG, Boggio V, Cutrera RA, Mautalen C. Melatonin effects on bone: experimental facts and clinical perspectives. J Pineal Res. 2003 Mar;34(2):81-7. doi: 10.1034/j.1600-079x.2003.00028.x.
99. Tresguerres IF, Clemente C, Blanco L, Khraisat A, Tamimi F, Tresguerres JA. Effects of local melatonin application on implant osseointegration. Clin Implant Dent Relat Res. 2012 Jun;14(3):395-9. doi: 10.1111/j.1708-8208.2010.00271.x.
100. Maria S, Samsonraj RM, Munmun F, Glas J, Silvestros M, Kotlarczyk MP, Rylands R, Dudakovic A, van Wijnen AJ, Enderby LT, Lassila H, Dodda B, Davis VL, Balk J, Burow M, Bunnell BA, Witt-Enderby PA. Biological effects of melatonin on osteoblast/osteoclast cocultures, bone, and quality of life: Implications of a role for MT2 melatonin receptors, MEK1/2, and MEK5 in melatonin-mediated osteoblastogenesis. J Pineal Res. 2018 Apr;64(3):10.1111/jpi.12465. doi: 10.1111/jpi.12465.
101. Amstrup AK, Sikjaer T, Heickendorff L, Mosekilde L, Rejnmark L. Melatonin improves bone mineral density at the femoral neck in postmenopausal women with osteopenia: a randomized controlled trial. J Pineal Res. 2015 Sep;59(2):221-9. doi: 10.1111/jpi.12252.
102. Yasser Z, Abdulkareem A, Saliem S. Effect of topical melatonin application on the peri-implant proximal bone level and cortical plate thickness (Pilot Clinical Trial). J Res Med Dent Sci. 2020;6:394-9. https://www.researchgate.net/publication/ 353670533_Effect_of_Topical_Melatonin_Application_on_the_Peri-Implant_Proximal_Bone_Level_and_Cortical_Plate_Thickness_Pilot_Clinical_Trial.
103. Ravella H, Rao MV, Manthena S, Koneru S, Preethi PL, Anumolu VN. The Effect of Melatonin on Implant Stability and Marginal Bone Level around The Implant. Journal of Dentistry Indonesia. 2022;29(2):105-12. DOI https://doi.org/10.14693/jdi.v29i2.1319.
104. Zijnge V, Meijer HF, Lie MA, Tromp JA, Degener JE, Harmsen HJ, Abbas F. The recolonization hypothesis in a full-mouth or multiple-session treatment protocol: a blinded, randomized clinical trial. J Clin Periodontol. 2010 Jun;37(6):518-25. doi: 10.1111/j.1600-051X.2010.01562.x.
105. Balaji TM, Varadarajan S, Jagannathan R, Mahendra J, Fageeh HI, Fageeh HN, Mushtaq S, Baeshen HA, Bhandi S, Gupta AA, Raj AT, Reda R, Patil S, Testarelli L. Melatonin as a Topical/Systemic Formulation for the Management of Periodontitis: A Systematic Review. Materials (Basel). 2021 May 6;14(9):2417. doi: 10.3390/ma14092417.
106. Thomas M, Setty S, Kaveeshwar V, Narayan Puranik S. Efficacy of Melatonin Supplementation as an Adjunct to Periodontal Therapy. International Journal of Drug Research and Dental Science. 2023;5(1):1-7. https://doi.org/10.36437/ijdrd.2023.5.1.A.
107. Cutando A, López-Valverde A, de Diego RG, de Vicente J, Reiter R, Fernández MH, Ferrera MJ. Effect of topical application of melatonin to the gingiva on salivary osteoprotegerin, RANKL and melatonin levels in patients with diabetes and periodontal disease. Odontology. 2014 Jul;102(2):290-6. doi: 10.1007/s10266-013-0122-5.
108. Cutando A, López-Valverde A, Gómez-de-Diego R, Arias-Santiago S, de Vicente-Jiménez J. Effect of gingival application of melatonin on alkaline and acid phosphatase, osteopontin and osteocalcin in patients with diabetes and periodontal disease. Med Oral Patol Oral Cir Bucal. 2013 Jul 1;18(4):e657-63. doi: 10.4317/medoral.18832.
109. Cutando A, Montero J, Gómez-de Diego R, Ferrera MJ, Lopez-Valverde A. Effect of topical application of melatonin on serum levels of C-reactive protein (CRP), interleukin-6 (IL-6) and tumor necrosis factor-alpha (TNF-α) in patients with type 1 or type 2 diabetes and periodontal disease. J Clin Exp Dent. 2015 Dec 1;7(5):e628-33. doi: 10.4317/jced.52604.
110. Konečná B, Chobodová P, Janko J, Baňasová L, Bábíčková J, Celec P, Tóthová Ľ. The Effect of Melatonin on Periodontitis. Int J Mol Sci. 2021 Feb 27;22(5):2390. doi: 10.3390/ijms22052390.
111. Harpsøe NG, Andersen LP, Gögenur I, Rosenberg J. Clinical pharmacokinetics of melatonin: a systematic review. Eur J Clin Pharmacol. 2015 Aug;71(8):901-9. doi: 10.1007/s00228-015-1873-4.
112. Bartoli AN, De Gregori S, Molinaro M, Broglia M, Tinelli C, Imberti R. Bioavailability of a new oral spray melatonin emulsion compared with a standard oral formulation in healthy volunteers. Journal of Bioequivalence and Bioavailability. 2012;4(7):96-9. https://doi.org/10.4172/jbb.1000120.
113. Madsen BK, Zetner D, Møller AM, Rosenberg J. Melatonin for preoperative and postoperative anxiety in adults. Cochrane Database Syst Rev. 2020 Dec 8;12(12):CD009861. doi: 10.1002/14651858.CD009861.pub3.
114. SaberMoghaddam M, Sheybani S, Bakhtiari E, Shakiba M. The Effect of Preoperative Sublingual Melatonin on Postoperative Pain Severity in Patients Undergoing Colorectal Surgery: A Triple-Blinded Randomized Trial. Med J Islam Repub Iran. 2022 Aug 10;36:90. doi: 10.47176/mjiri.36.90.
115. El-Sharkawy H, Elmeadawy S, Elshinnawi U, Anees M. Is dietary melatonin supplementation a viable adjunctive therapy for chronic periodontitis?-A randomized controlled clinical trial. J Periodontal Res. 2019 Apr;54(2):190-197. doi: 10.1111/jre.12619.
116. Araújo EG, Oliveira DMSL, Martins CC, Stefani CM. Efficacy of Antioxidant Supplementation to Non-Surgical Periodontal Therapy on Metabolic Control in Type 2 Diabetes Patients: A Network Meta-Analysis. Antioxidants (Basel). 2022 Mar 24;11(4):621. doi: 10.3390/antiox11040621.
117. Delpino FM, Figueiredo LM, Nunes BP. Effects of melatonin supplementation on diabetes: A systematic review and meta-analysis of randomized clinical trials. Clin Nutr. 2021 Jul;40(7):4595-4605. doi: 10.1016/j.clnu.2021.06.007.
118. Chitsazi M, Faramarzie M, Sadighi M, Shirmohammadi A, Hashemzadeh A. Effects of adjective use of melatonin and vitamin C in the treatment of chronic periodontitis: A randomized clinical trial. J Dent Res Dent Clin Dent Prospects. 2017 Fall;11(4):236-240. doi: 10.15171/joddd.2017.041.
119. Заболевания пародонта: учебное пособие /Иванов В.С., Почивалин В.П., Иванова Е.В., Сабанцева Е.Г., Басова Т.В., Ежова Е.Г., Ломагин В.В.: ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования. – М.: ФГБОУ ДПО РМАНПО, 2017. – 94с. ISBN 978-5-7249-2660-7 10,14. Periodontal diseases: textbook / Ivanov V.S., Pochivalin V.P., Ivanova E.V., Sabantseva E.G., Basova T.V., Ezhova E.G., Lomagin V.V.: FGBOU DPO Russian Medical Academy of Continuous Professional Education. – M.: FGBOU DPO RMANPO, 2017. – 94 p. ISBN 978-5-7249-2660-7 10.14.
120. Тихонова О.И. Применение препаратов на основе гиалуроновой кислоты и диодного лазера при хирургическом лечении пациентов с хроническим пародонтитом средней и тяжелой степени. Дисс. на соиск. уч. степ. к.м.н. М.: ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет), 2019. Tikhonova O.I. The use of preparations based on hyaluronic acid and diode laser in the surgical treatment of patients with moderate and severe chronic periodontitis. Diss. for the competition uch. step. PhD Moscow: First Moscow State Medical University named after I.M. Sechenov (Sechenov University), 2019.
121. Профилактика стоматологических заболеваний: учебное пособие / С.И. Бородовицина, Н.А.Савельева, Е.С.Таболина; ФГБОУ ВО РязГМУ Минздрава России. – Рязань: ОТСиОП, 2019. – 264 с. Prevention of dental diseases: textbook / S.I. Borodovitsina, N.A. Savelyeva, E.S. Tabolina; FGBOU VO RyazGMU of the Ministry of Health of Russia. – Ryazan: OTSiOP, 2019. - 264 p.
122. Орлова С. В., Никитина Е. А., Балашова Н. В., Пигарева Ю. А., Анкваб Э. В., Хаджимуратова Т. И. Роль экзогенного мелатонина в регуляции сна. Медицинский алфавит. 2022; (25): 26–33. https://doi.org/10.33667/2078‑5631‑2022‑25‑26‑33. Orlova S.V., Nikitina E.A., Balashova N.V., Pigareva Yu.A., Ankvab E.V., Khadzhimuratova T.I. The role of exogenous melatonin in the regulation of sleep. Medical alphabet. 2022; (25): 26–33. https://doi.org/10.33667/2078‑5631‑2022‑25‑26‑33.
123. Фукс Е.И., Карева Ю.А., Гализина О.А., Таболина Е.С. Современные аспекты этиологии и патогенеза заболеваний пародонта. Российский медико-биологический вестник имени академика И.П. Павлова. 2013;3:153–160. Fuks E.I., Kareva U.A., Galizina O.A., Tabolina E.S. Modern aspects of etiology and pathogenesis of diseases of parodont. Rossiyskiy mediko-biologicheskiy vestnik imeni akademika I.P. Pavlova. 2013;21(3):153-60. Available from: https://doi.org/10.17816/PAVLOVJ20133153-160.
124. Bannai M, Kawai N. New therapeutic strategy for amino acid medicine: glycine improves the quality of sleep. J Pharmacol Sci. 2012;118(2):145-8. doi: 10.1254/jphs.11r04fm.
125. Инструкция по медицинскому применению лекарственного препарата, рег. номер: ЛП‑007897. Instructions for the medical use of a medicinal product, reg. number: LP‑007897.
126. Инструкция по медицинскому применению лекарственного препарата, рег. номер: ЛП‑005295. Instructions for the medical use of a medicinal product, reg. number: LP‑005295.
Публикация выполнена при поддержке Программы стратегического академического лидерства РУДН.
The publication was supported by the Strategic Academic Leadership Program of the PFUR (RUDN).
Информация об авторах
Орлова Светлана Владимировна1,2, д. м. н., проф., зав. кафедрой диетологии и клинической нутрициологии, главный научный сотрудник.
E-mail: orlova-sv@rudn.ru.ORCID: 0000-0002-4689-3591.
Зырянов Сергей Кенсаринович1, д. м. н., заведующий кафедрой общей и клинической фармакологи Медицинского института.
E-mail: zyryanov-sk@rudn.ru. ORCID:0002-0002-6348-6867.
Никитина Елена Александровна1,2, к. м. н., доцент кафедры диетологии и клинической нутрициологии, научный сотрудник.
E-mail: nikitina-ea1@rudn.ru. ORCID: 0000-0003-3220-0333.
Тигай Юлия Олеговна1, ассистент кафедры патологической анатомии Медицинского института.
E-mail: chen_juliya@gmail.com. ORCID: 0000-0002-6500-9220.
Орлова Анастасия Алексеевна1, студентка Медицинского института.
E-mail: 1032202909@rudn.ru.
Грабовский Григорий Андреевич3, студент лечебного факультета.
E-mail: Gregorygrab@icloud.com. ORCID: 0009-0000-2077-2233.
1 ФГАОУ ВО «Российский университет дружбы народов» имени Патриса Лумумбы.
2 ГБУЗ Научно-практический центр детской психоневрологии департамента здравоохраненияг. Москвы, Россия.
3 ФГАОУ ВО «Российский Национальный Исследовательский Медицинский Университет им. Н.И.Пирогова» Министерства здравоохранения Российской Федерации.
Контактная информация:
Орлова Светлана Владимировна. E-mail: rudn_nutr@mail.ru
Author information
Orlova Svetlana Vladimirovna1,2, Doctor of Medical Sciences, Professor, Head of the Department of Dietology and Clinical Nutrition.
E-mail: orlova-sv@rudn.ru. ORCID: 0000-0002-4689-3591.
Zyryanov Sergey Kensarinovich1, MD Head of the Department of General and Clinical Pharmacology of the Medical Institute.
E-mail: zyryanov-sk@rudn.ru. ORCID:0002-0002-6348-6867.
Nikitina Elena Alexandrovna1,2, Ph.D., assistant professor, Department of Dietology and Clinical Nutrition.
E-mail: nikitina-ea1@rudn.ru. ORCID: 0000-0003-3220-0333.
Tigay Yuliya Olegovna1, Assistant of the Department of Pathological Anatomy of the Medical Institute.
E-mail: chen_juliya@gmail.com. ORCID: 0000-0002-6500-9220.
Orlova Anastasia Alekseevna1, student of the Medical Institute.
E-mail: 1032202909@rudn.ru.
Grabovsky Grigory Andreevich3, student of the medical faculty.
E-mail: Gregorygrab@icloud.com. ORCID: 0009-0000-2077-2233.
1 Federal State Autonomous Educational Institution of Higher Education «Peoples’ Friendship University of Russia» named after Patrice Lumumba.
2 Scientific and Practical Center for Child Psychoneurology, Moscow Department of Health, Russia.
3 Federal State Autonomous Educational Institution of Higher Education «N.I. Pirogov Russian National Research Medical University» of the Ministry of Health of the Russian Federation.
Contact information:
Orlova Svetlana V. E-mail: rudn_nutr@mail.ru




