Роль отдельных нейронутриентов в оптимизации алиментарной терапии неврологических пациентов

С.В. Орлова 1, 2, Е.А. Никитина 1, 2, Н.В. Балашова1, С.Г. Грибакин3, Е.В. Прокопенко4, А.Н. Водолазкая5, Ю.А. Пигарева6
1 ФГАОУ ВО «Российский университет дружбы народов»(РУДН), Москва
2 ГБУЗ «Научно-практический центр детской психоневрологии Департамента здравоохранения Москвы», Россия
3 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
4 ООО «ИНВИТРО», Москва
5 Австрийская клиника микронутриентной терапииBiogena, Москва, Россия
6 ГБУЗ «Городская клиническая больница имени В.В. Виноградова Департамента здравоохранения Москвы», Россия
РЕЗЮМЕ
Нейродиетология – мультидисциплинарная наука, основанная на знаниях нейронауки и ди-етологии и имеющая своей целью оптимизацию терапии психоневрологических заболева-ний посредством качественного и количественного модулирования составом рационов питания, алиментарную профилактику болезней нервной системы, когда последняя возможна, а также оптимизацию психомоторных и интеллектуальных функций. Следует отметить, что нейродиетология и подходы к выбору лечебного питания с каждым годом занимают все более прочное положение в мировой клинической медицине. Вариабельность нутритивных подходов к практическому лечению неврологической патологии у пациентов отражает мно-гогранность современной нейродиетологии. Поэтому не случайно нейродиетология детского возраста получила в России широкое применение, чего нельзя сказать о нутритивных подходах в лечении взрослых пациентов этого профиля. Кроме того, нарушения нутритив-ного статуса и отсутствие своевременной его коррекции снижают эффективность реабилитационных мероприятий – важнейшего звена в комплексном лечении неврологических пациентов, профилактике инвалидизации и повышении социальной адаптации. При невоз-можности обеспечить адекватный уровень потребления пищевых веществ и энергии стан-дартным путем необходимо своевременно назначить нутритивную поддержку с использованием специализированных пищевых продуктов, включая биологически активные добавки к пище.
КЛЮЧЕВЫЕ СЛОВА:минеральныевещества, витамины, микроэлементы, когнитивные нарушения, макро- и микронутриенты, нейропротекторы, нейронутриенты, тирозин, холин, ГАМК, глицин, магний, пиридоксин, пиридоксаль, нейродиетология, профилактика, коррекция.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Публикация выполнена при поддержке Программы стратегического академического лидерства РУДН.
The role of individual neuronutrients in optimizing nutritional therapy for neurological patients
S.V. Orlova1, 2, E.A. Nikitina1, 2, N.V. Balashova1, S.G. Gribakin3, E.V. Prokopenko4, A.N. Vodolazkaya5,Yu.A. Pigareva6
1 Peoples' Friendship University of Russia, Moscow, Russia
2 Scientific and Practical Center for Child Psychoneurology, Moscow Department of Health, Russia
3 Russian Medical Academy of Continious Professional Education, Moscow, Russia
4 ”INVITRO” Limited Liability Company, Moscow, Russia
5 Austrian clinic for micronutrient therapy Biogena, Moscow, Russia
6 City Clinical Hospital n.a. V.V. Vinogradov, Moscow, Russia
SUMMARY
Neurodietology is a multidisciplinary science based on knowledge of neuroscience and dietology and aiming to optimize the treatment of neuropsychiatric diseases through qualitative and quantita-tive modulation of the composition of diets, alimentary prevention of diseases of the nervous system, when the latter is possible, as well as optimization of psychomotor and intellectual functions. It should be noted that neurodietology and approaches to the choice of therapeutic nutrition every year occupy an increasingly strong position in world clinical medicine. The variability of nutritional approaches to the practical treatment of neurological pathology in patients reflects the versatility of modern neurodietology. Therefore, it is no coincidence that childhood neurodietology has been widely used in Russia, which cannot be said about nutritional approaches in the treatment of adult patients of this profile. In addition, violations of the nutritional status and the lack of its timely correction reduce the effectiveness of rehabilitation measures - the most important link in the complex treatment of neurological patients, prevention of disability and increasing social adaptation. If it is impossible to provide an adequate level of intake of nutrients and energy in the standard way, it is necessary to prescribe nutritional support in a timely manner using specialized food products, includ-ing biologically active food supplements.
KEYWORDS: minerals, vitamins, trace elements, cognitive impairment, macro-micronutrients, neuroprotectors, neuronutrients, tyrosine, choline, GABA, glycine, magnesium, pyridoxine, pyridoxal, neurodietology, prevention, correction.
CONFLICT OF INTEREST. The authors declare no conflict of interest.
The publication was made with the support of the RUDN University Strategic Academic Leadership Program.
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае выс-шего примата [1]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях [2]. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно – передают только полезную информацию и затрачивают при этом минимум энергии.
Мозг является наиболее сложным органом в организме человека с высоким и посто-янным спросом на вводимые вещества. Оптимальное питание имеет важное значение для полноценного функционирования мозга не только из-за поступления энергии, но также из-за адекватного поступления макронутриентов и микроэлементов для синтеза нейротранс-миттеров и белковых компонентов. Витамины, минералы и другие компоненты рациона также составляют так называемые нейронутриенты [3–7].
Особенность микронутриентов состоит в том, что их дефицит вызывает изменения в наиболее тонкой и существенной для жизни человека сфере, сфере когнитивных функций, которые включают память, внимание, способность к сосредоточению и обучению, эмоцио-нальную сферу и др. Эти нарушения могут быть малозаметны на ранних этапах развития, но могут приводить к долговременным неблагоприятным последствиям в работе ЦНС, что мо-жет сопровождаться снижением способности к обучению, поведенческими нарушениями и в конечном итоге снижением качества жизни человека.
Подавляющее большинство синапсов (около 99%) у человека являются химическими. Передача информации в химических синапсах происходит при помощи нейротрансмитте-ров. В настоящее время известно о существовании большого числа нейротрансмиттеров, опосредующих взаимодействие нейронов. Нейротрансмиттеры подразделяются на две большие группы: нейромедиаторы (глутамат, ГАМК, ацетилхолин и др.) и нейромодуляторы (норадреналин, дофамин, серотонин и др.). Нейромедиаторы – это биологически активные химические вещества, вырабатываемые нервными клетками. Именно благодаря им проис-ходит передача электрохимического импульса от нервной клетки через синаптическое про-странство между нейронами и, в свою очередь, от нейронов к другим клеткам, тканям и ор-ганам.По классификации среди нейромедиаторов различают аминокислоты, пептиды и моноами-ны. По своим функциям делятся на возбуждающие и тормозные.
По классификации среди нейромедиаторов различают аминокислоты, пептиды и моноамины. По своим функциям делятся на возбуждающие и тормозные.
Аминокислота ГАМК, или гамма-аминомасляная кислота, и глицин являются основными медиаторами, опосредующими торможение в ЦНС вследствие выраженной гиперполяриза-ции постсинаптических клеток, обусловленной входом отрицательно заряженных ионов хлора внутрь клетки. Широко представленные на пресинаптических терминалях ГАМК-рецепторы выступают в качестве гетерорецепторов, контролирующих высвобождение ме-диатора из дофамин-, норадреналин-, серотонин- и глутаматергических нейронов. Актива-ция ГАМК-рецепторов миндалины снимает состояние тревоги, а снижение их количества или блокада вызывает развитие судорожных состояний, наблюдаемых при эпилепсии. Не исключена роль ГАМК-ергической системы мозга в процессах долговременной памяти и развитии некоторых нейродегенеративных заболеваний [8–10].
Аминокислота является участником нейромедиаторных и метаболических процессов головного мозга. Установлено, что ГАМК с трудом преодолевает гематоэнцефалический ба-рьер, и к головному мозгу она транспортируется с помощью мембранных транспортеров, действующих в различных участках мозга при различных физиологических условиях. Транспортеры плазматической мембраны приводятся в действие электрохимическим гради-ентом для натрия, который образуется Na+/K+-ATФ-азой.
ГАМК активирует энергетические процессы мозга, повышает дыхательную актив-ность тканей, увеличивает утилизацию мозгом глюкозы, усиливает кровоснабжение в го-ловном мозге. Метаболизм ГАМК – изменчивый параметр, регуляция которого обеспечива-ет синаптическую пластичность в интернейронах гиппокампа, неокортекса и гипоталамуса [11].
Образуется ГАМК путем декарбоксилирования L-глутаминовой кислоты и утилизи-руется в ходе реакции переаминирования с альфа-кетоглутаровой кислотой. Глутаматдекар-боксилаза и ГАМК-трансаминаза являются пиридоксалевыми ферментами. Это происходит путем декарбоксилирования по следующей реакции:
HOOC-CH2-CH2-CH(NH2)-COOH → CO2 + HOOC-CH2-CH2-CH2NH2.
Совокупность реакций образования и утилизации ГАМК в мозговой ткани известна как ГАМК-шунт. Выход энергии в ходе реакций ГАМК-шунта на один АТФ меньше, однако скорость перехода альфа-кетоглутаровой кислоты в янтарную выше, чем в комплексе реак-ций с участием сукцинил-КоА.
Наибольшее количество ГАМК обнаружено в черной субстанции, бледном шаре и гипоталамусе. По содержанию в различных отделах ЦНС ГАМК во много раз превышает другие нейромедиаторы. В гипоталамусе содержание ГАМК составляет 600 мкг/г.
Кроме постсинаптического торможения ГАМК принимает участие в пресинаптиче-ском торможении, уменьшая секрецию ацетилхолина из пресинаптической мембраны. Наряду с этим из-за сходства химического строения с ацетилхолином ГАМК может вступать с ним в конкуренцию за рецепторные участки на постсинаптической мембране.
Установлена роль ГАМК в миграции вновь генерированных нервных клеток-предшественников к месту «назначения». Тормозным медиатором ГАМК становится только в зрелом мозге. Было показано, что в период созревания головного мозга ГАМК оказывает хемотаксические эффекты по кальций-зависимому механизму, управляя миграцией вновь генерированных эмбриональных нейронов из вентрикулярной зоны в кортикальную пла-стинку [12]. В нервной системе ГАМК-ергические нейроны возбуждают клетки, тем самым меняют проницаемость мембраны для ионов хлора. В незрелых нервных клетках концен-трация ионов хлора будет выше, чем в окружающей среде, в результате чего стимуляция ре-цепторов ГАМК приводит к выходу этих анионов из клетки с последующей деполяризации мембраны. Со временем созревает глутаматная система мозга, ГАМК приобретает роль тор-мозного нейромедиатора [13]. В зависимости от степени развития нейронов изменяется ме-ханизм развития деполяризации под влиянием ГАМК. Одна из причин развития деполяри-зации мембраны – повышение внутриклеточной проницаемости для [Ca2+] под влиянием ГАМК как у эмбриональных клеток [14], так и в ранний постнатальный период [15].
ГАМК поддерживает нейрональную возбудимость посредством активации ГАМК-рецепторов [16], которая приводит как к выходу [Cl-] из нейрона (обеспечивая мембранную деполяризацию), так и к активации потенциал зависимых Ca2+ каналов и повышению [Ca2+] [17, 18]. Несмотря на то что способность в незрелых нейронах повышать [Ca2+] раньше приписывалась только глутамату, было доказано, что в большей степени эта способ-ность присуща ГАМК [19]. Кроме того, ГАМК обладает способностью к новому, противо-положному тормозному влиянию, эффекту – деполяризации нейронов за счет длительного (более недели) увеличения концентрации [Ca2+] в поврежденных клетках [20].
В регуляторных механизмах окислительных процессов нервных клеток значение имеет не общее содержание ГАМК в мозге, а ее распределение во внутри- и внеклеточном пространстве. Следовательно, ГАМК может выполнять функцию передатчика сигнала в нейрон-нейроглиальной системе.
Ряд производных соединений от ГАМК стимулируют созревание структур мозга и образование стойких связей между популяциями нейронов. Это способствует формирова-нию памяти и ускорению восстановительных процессов после различных поражений мозга. Основная функция ГАМК как ингибирующего нейромедиатора – блокирование или подав-ление определенных нервных импульсов. Под его воздействием снижается активность нервной системы и развивается успокаивающий эффект. Происходит снижение или устра-нение чувства беспокойства, тревоги, страха. Тормозящее действие позволяет предупредить судорожные припадки.
Для коррекции состояния ГАМК-дефицита используется витамин В6. Он обеспечивает протекание многих реакций (цикла Кребса), в процессе которых углеводы перерабатывают-ся в АТФ. В ходе реакций декарбоксилирования происходит образование ГАМК из глута-миновой кислоты и серотонина из триптофана. А ГАМК и серотонин, в свою очередь, яв-ляются основными тормозными медиаторами в центральной нервной системе. Таким обра-зом пиридоксин регулирует возбудимость центральной нервной системы, не позволяя ей чрезмерно усиливаться. Благодаря этому при дефиците витамина В6 появляются признаки чрезмерного возбуждения ЦНС, такие как склонность к судорогам, экзальтации и т. д.
Подавляя активность нервной системы, гамма-аминомасляная кислота облегчает про-цесс засыпания, устраняет умственное перенапряжение, создает внутреннее спокойствие и умиротворение. ГАМК регулирует и поддерживает нормальный мышечный тонус.
Дефицит ГАМК вызывает расстройства, связанные с употреблением психоактивных веществ, в том числе алкоголя и снотворных средств. Если не хватает ГАМК, то синапсы недостаточно активны и возникает дисбаланс возбуждения и торможения. В легком случае возникает повышенная тревожность, импульсивность, в более тяжелом – бессонница. У де-тей наблюдается синдром дефицита внимания и гиперактивности: не хватает внимания и слишком много двигательных реакций [21, 22]. ГАМК способна бороться с чрезмерной ак-тивностью и создавать условия для поддержания баланса в головном мозге. Кроме того, аминокислота оказывает положительное влияние на качество сна, способствуя быстрому за-сыпанию. Также ГАМК улучшает усвояемость глюкозы мозгом и процесс кровообращения в его тканях.
Стоит отметить, что ГАМК имеет большое значение в питании для спортсменов, так как с помощью нее усиливается выработка белка и замедляется его распад, уменьшается со-держание жировой и увеличивается количество мышечной ткани организма.
Глицин – это простейшая алифатическая аминокислота, единственная протеиноген-ная аминокислота, не имеющая оптических изомеров. Получают аминоуксусную кислоту при химической реакции аммиака и хлоруксусной кислоты.
CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2—CH2COOH + NH4Cl
Более того, и для синтеза глицина в организме человека клетке не требуется прила-гать значительных усилий ввиду относительной простоты химической организации его мо-лекул [23].Глицин входит в состав большинства растительных и животных белков. В организме гли-цин играет незаменимую роль в синтезах белков, пуриновых нуклеотидов, гема гемоглоби-на, парных желчных кислот, креатина, глутатиона и др. Легко проникает в большинство биологических жидкостей и тканей организма, в т. ч. в головной мозг, метаболизируется до воды и углекислого газа и не накапливается в тканях.
Более 70 плацебо-контролируемых клинических испытаний с соединениями модуляторного участка глицина (включая глицин, D-серин, D-циклосерин и бензоат натрия), часто назнача-емыми в качестве дополнения к нейролептикам, показали непостоянное и в лучшем случае умеренное улучшение негативных симптомов или когнитивных областей. Такие противоре-чивые результаты могут быть связаны с колоколообразным эффектом доза-ответ; десенсиби-лизация при длительном введении агонистов глицина или мускариновое действие нейро-лептиков, препятствующее любому улучшению когнитивных функций, или изменение фар-макологического эффекта используемых агонистов глицина, частичных агонистов и инги-биторов GlyT1. Для сравнения: другой недавний метаанализ показал, что модуляторы NMDA (глицин и D-серин) более эффективны, чем амисульпирид, рисперидон и оланзапин, в уменьшении негативных симптомов у подростков с клинически высоким риском развития психоза. Таким образом, такие препараты могут иметь потенциальное применение для предотвращения перехода субъектов сверхвысокого риска в полномасштабный психоз и ши-зофрению. Они также требуют дальнейшего изучения в качестве лечения расстройств аути-стического спектра [24].
Глицин также является нейромедиатором тормозного типа действия, необходимым для реа-лизации эффектов глутамата. У него наблюдается способность блокировать многие инфор-мационные потоки. Также глицин является пищевой аминокислотой, входящей в состав белков. Как составная часть белка, он был идентифицирован еще в начале XIX века.
Рецепторы глицина расположены на многих участках головного и спинного мозга. Обна-ружена совместная локализация глицина с ГАМК в нейронах спинного мозга и мозжечка. Установлено, что глицин дополняет активность ГАМК в спинном мозге и стволовых струк-турах, обеспечивает торможение мотонейронов, предотвращая их избыточное возбуждение [25]. Глициновые нейроны – интернейроны моторных ядер (в спинном мозгу – клетки Рен-шоу). Активация этих нейронов происходит через коллатерали отходящих от аксонов мото-нейронов. По этой причине его часто назначают при повышенном тонусе мышц. Еще одним примером необходимости организма в глицине является то, что он входит в состав опиоид-ных пептидов: 2 молекулы глицина следуют за тирозином в структуре энкефалинов [26].
Глицин является вспомогательным медиатором, передающим тормозное влияние в синапсах [26]. Исключительная роль синапсов в передаче тормозных влияний в цепи нейронов позво-ляет рассматривать эти структуры в качестве основополагающих единиц нервной системы. Знание особенностей работы синапсов, процессов торможения и синаптической задержки позволяет выстраивать соответствующую терапевтическую стратегию для минимизации нежелательных реакций при использовании глицина. Поэтому его назначают в различных дозировках, определяемых возрастом пациента, видом и степенью его заболевания [27, 28]. Обладает глицин и ГАМК-ергическим, α1-адреноблокирующим, антиоксидантным и анти-токсическим действием, за счет чего наблюдается улучшение мозгового кровотока иобщестимулирующее влияние на организм. Благодаря тому, что медиатор нормализует и ак-тивирует процессы защитного торможения в ЦНС и регулирует деятельность глутаматных (NMDA) рецепторов, проявляется нейрометаболическое, антиоксидантное, нейропротек-тивное действие глицина [29]. Регуляция деятельности NMDA-рецепторов позволяет гли-цину уменьшать выраженность таких процессов при шизофрении и эпилепсии.
Показано, что глицин обладает свойствами цитопротектора в условиях гентамицинового повреждения почек у крыс. Его применение предупреждает почечную недостаточность, предотвращает развитие окислительного стресса и снижение активности антиоксидантных ферментов [30, 31].
Глицин уменьшает психоэмоциональное напряжение, агрессивность и конфликт-ность; улучшает социальную адаптацию и настроение, облегчает засыпание и нормализует сон; повышает умственную работоспособность; уменьшает выраженность вегетативно-сосудистых нарушений (в т. ч. и в климактерическом периоде) и общемозговых расстройств при ишемическом инсульте и черепно-мозговой травме, токсическое действие этанола на ЦНС.
Таким образом, глицин – важнейший компонент антиноцицептивной и опиоидэргической стресс-лимитирующей систем. Достаточное поступление глицина с пищей либо его прием в качестве БАД способны обеспечить поддержание нормальной работы синапса – залог обес-печения тормозных влияний на нейроны, регуляции притока информации в ЦНС, выполне-ния сложных функций, участия в процессах образования памяти, обучения, рефлекторных реакций, пластичности мозга и адаптации.
Тирозин (α-амино-β-(n-гидроксифенил) пропионовая кислота) – ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах – L и D и в виде рацемата (DL). По строению соединение отличается от фенилаланина наличием фенольной гидрок-сильной группы в пара-положении бензольного кольца.
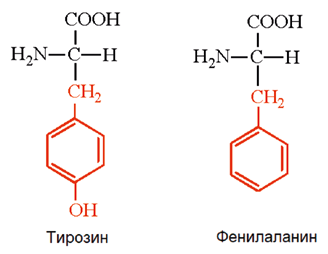
Тирозин – условно-незаменимая аминокислота, является предшественником нейромедиато-ров норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтирони-на, пигментов. Тирозин необходим для нормальной работы надпочечников, щитовидной железы и гипофиза, создания эритроцитов и лейкоцитов, синтеза меланина, пигмента кожи и волос [27].
В дофаминергических клетках головного мозга тирозин превращается в L-ДОФА с помо-щью фермента тирозингидроксилазы. Это фермент, ограничивающий скорость, участвую-щий в синтезе нейромедиатора дофамина. После высвобождения и взаимодействия с рецеп-торами оставшийся дофамин подвергается активному обратному захвату в нервное оконча-ние. Уровень дофамина в нервных окончаниях регулируется МАО (разрушающей дофамин) и тирозингидроксилазой. Дофамин, регулирует давление крови и мочеиспускание, а также участвует в первом этапе синтеза норэпинефрина (норадреналина) и эпинефрина (адренали-на) при гидроксилировании дофамин-бета-гидроксилазой. Также из тирозина в организме синтезируются ряд важных веществ: тирамин и 3,4-дигидроксифенилаланин (предшествен-ники катехоламинов), а также дийодтирозин, из которого образуется гормон тироксин.
Благодаря способности тирозина влиять на уровни нейротрансмиттеров в периферической или центральной нервной системе он улучшает интеллектуальные функции, оказывает стресс-протекторное, антидепрессантное и психостимулирующее, антиаллергическое дей-ствие. Также тирозин регулирует функции щитовидной железы, надпочечников и гипофиза, нормализует пониженное артериальное давление, подавляет аппетит, способствует миними-зации жировых отложений [32].
При дефиците этой аминокислоты у человека может наблюдаться пониженное арте-риальное давление и температура тела, неконтролируемый набор массы тела, синдром бес-покойных ног [33]. При заболеваниях почек синтез тирозина в организме может резко осла-биться, поэтому в этом случае его необходимо обязательно дотировать [34]. Недостаток ти-розина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. При хронической депрессии, для которой не существует общепринятых методов лечения, потребление 100 мг тирозина в день приводит к существенному улучшению [35].
Низкое содержание тирозина в плазме связано с гипотиреозом. Больной может испытывать вялость и сонливость, быстро уставать. У людей, страдающих хроническим дефицитом ти-розина, могут появиться тяжелые умственные и физические нарушения [36].
Поэтому тирозин рекомендуется для нормализации работы щитовидной железы, для снятия стресса, головных болей, нервных расстройств. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке меланина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Тирозин также необходим в следующих ситуациях: психоэмоциональный стресс, потреб-ность в психостимулирующем эффекте, состояния вялости и усталости, мигрень, болезнь Паркинсона, состояния гиперактивности с дефицитом внимания, гипотония, аллергические состояния, реабилитация при кокаиновой зависимости и алкоголизме и др. [37, 38].
Холин. Холин является четвертичным аммониевым соединением с химической формулой (2-гидроксиэтил-)-триметиламмоний.
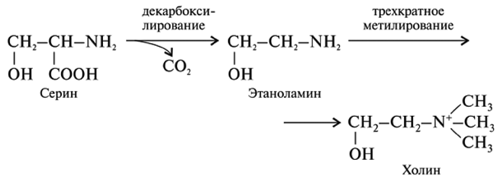
В физиологических условиях холин содержится в клетках, тканях и биологических жидко-стях организма в основном в ковалентно связанной форме, в составе фосфолипидов (напри-мер, в составе эфиров фосфатидилхолина), в составе липопротеидов очень низкой плотно-сти (ЛПОНП), в составе цитозин-дифосфат-холина (ЦДФ-холина) и др. [39].
Холин и его производные выполняют в организме человека множество физиологических функций:
1) холин является предшественником фосфатидилхолина и сфингомиелина, входящих в со-став большинства клеточных мембран организма человека. В клетках различных тканей и органов человека в среднем 40–50% от общего содержания фосфолипидов в их мембранах составляют именно эфиры фосфатидилхолина с различными жирными кислотами. В чело-веческом мозге этот процент еще выше и достигает 60% [40];
2) холин является источником для синтеза некоторых сигнальных молекул и нейротранс-миттера ацетилхолина. Холин-содержащие фосфолипиды образуют вместе с эфирами холе-стерина так называемые липидные рафты, которые создают на поверхности клеток и кле-точных органелл подходящие условия (активные центры или домены) для размещения кле-точных рецепторов или ферментов, играющих роль в каскадах внутриклеточной передачи сигнала [41]:
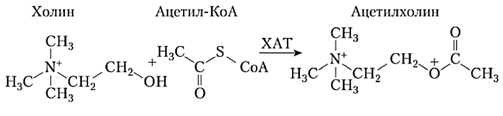
3) холин необходим для трансметилирования глицина и образования из него триметилглицина (бетаина):
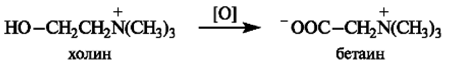
Бетаин является важным регулятором внутриклеточного осмотического давления (осморе-гулятором) и важным донором свободных метильных радикалов. В этом качестве холин и образующийся при его участии бетаин необходимы для нормальной работы так называемого одноуглеродного цикла, для превращения вредного и токсичного гомоцистеина в метионин и затем в S-аденозил-метионин (SAMe), в свою очередь, являющийся универсальным доно-ром метильных радикалов во многих других биохимических реакциях [42]. В свою очередь, нормальная работа «одноуглеродного цикла» и достаточное присутствие S-аденозил-метионина нужны для нормальной работы фолатного цикла и для образования биологиче-ски активной восстановленной и метилированной формы фолата (витамина B9 ) – метилен-тетрагидрофолата (МТФ), а также для образования биологически активной метилированной, коферментной формы витамина B12 – метилкобаламина [43].
Между тем витамин B9 (фолаты) и витамин B12 в его коферментной форме (метилкобала-мин или кобамамид), в свою очередь, критически необходимы и для обеспечения нормаль-ного процесса репарации ДНК, и для обеспечения нормального деления клеток (на этом ос-новано антимитотическое, цитостатическое действие антиметаболита фолатов – метотрекса-та), и для обеспечения биосинтеза моноаминов, и для протекания ряда других ферментатив-ных реакций, включая митохондриальное дыхание, окислительно-восстановительные реак-ции [44].
Одна из важнейших физиологических ролей холина и заключается в биосинтезе ацетилхо-лина (АцХ) – одного из важнейших, наряду с моноаминами (норадреналином, дофамином и серотонином), нейромедиаторов в центральной и периферической нервных системах, един-ственного передатчика сигналов в нервно-мышечной пластинке, и одного из важнейших, наряду с катехоламинами (адреналином, норадреналином и дофамином), гормонов мозгово-го слоя надпочечников [45].
Ацетилхолин – сложный эфир холина и уксусной кислоты.
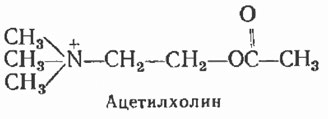
Широко представлен в различных отделах ЦНС, особенно в базальных ганглиях, таламусе и сером веществе больших полушарий головного мозга, где его содержание в несколько раз превышает содержание в белом веществе больших полушарий головного мозга. Наименьшее количество АцХ содержится в мозжечке. Свободный АцХ находится во внеклеточном про-странстве, лабильно связанный – в цитоплазме, а прочно связанный – в синаптических ве-зикулах, роль которых заключается в синтезе, хранении и секреции АцХ.
В ЦНС ацетилхолин вовлечен в контроль двигательной активности и процессов, связанных с обучением и памятью. Дисфункция холинергической системы наблюдается при нейроде-генеративных заболеваниях, в частности при болезни Альцгеймера. При этом уменьшается активность ацетилхолинэстеразы (АХЭ) в нейронах коры больших полушарий, гиппокапма и миндалины, снижается биосинтез АцХ и обратный захват холина, отмечается разрушение холинергических нейронов базальных ядер и уменьшение количества н-холинорецепторов в нейронах гиппокампа.
В ходе развития болезни Паркинсона отмечается гиперактивность нейронов полосатого те-ла, как следствие – снижение активности дофаминергических структур среднего мозга, а при хорее Гентингтона, напротив, потеря нейронов corpus striatum.
Для синтеза медиатора ацетилхолина нервная ткань получает холин извне, поскольку в моз-ге практически не синтезируется и поступает туда из крови через гематоэнцефалический ба-рьер. При этом часть холина используется для синтеза лецитина и убихинона [46]:
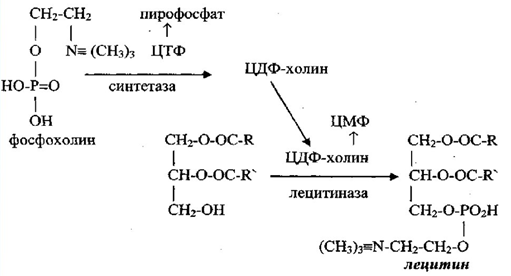
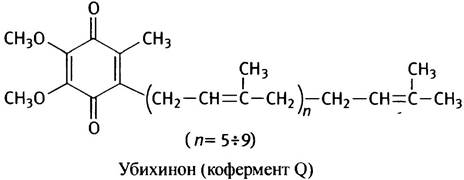
Внутриклеточное содержание холина в ткани мозга составляет более 50%, остальная его часть захватывается терминалями из синаптической щели после гидролиза и используется повторно. Захваченный холинергическими терминалями холин (60–70%) сразу превращает-ся в ацетилхолин. Расщепление АцХ происходит под действием АХЭ. АХЭ является ти-пичным ферментом нейронов, локализованным в синаптических мембранах, где инактиви-рует «отработанный» АцХ [47].
Таким образом, холин положительно влияет на нервную систему, оказывая антидепрессант-ное действие: в процессе обмена веществ из холина получаются волокна со способностью передавать нервные импульсы. В нужное время механизмы срабатывают, и образуются гор-моны, положительно влияющие на работоспособность мозга и общее состояние человека. Холин играет большую роль в нормальном функционировании нервной системы. Он участ-вует в образовании защитной миелиновой оболочки нервов. Присутствие холина в орга-низме предохраняет от разрушения миелинового слоя, от повреждения нервных клеток [48–51].
Витамин B6 (пиридоксин, пиридоксаль, пиридоксамин) участвует в метаболизме аминокислот, углеводов и жиров, необходим для нормального кроветворения, функциони-рования ЦНС и периферической нервной системы. Витамин B6 обеспечивает синаптиче-скую передачу, процессы возбуждения/торможения в ЦНС, участвует в транспорте сфинго-зина, входящего в состав оболочки нервов, и в синтезе катехоламинов.
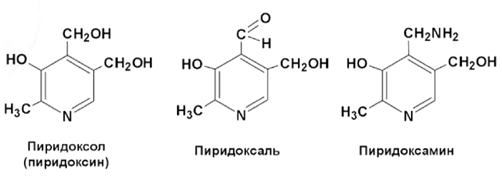
Пиридоксаль-5’-фосфат (P-5-Р) – биологически активная форма витамина B6, которая яв-ляется кофактором около 80 P-5-P-зависимых ферментов, вовлеченных в метаболизм угле-водов, аминокислот, гема- и нейротрансмиттеров.
Систематический анализ биологической роли этих ферментов позволил установить следу-ющие механизмы действия витамина B6 на организм:
1. Энергетический метаболизм клетки и синтез АТФ (ответ на гипоксию, катаболизм гликогена и глюконеогенез, митохондриальный матрикс, метаболизм 2-оксоглутарата, мета-болизм глиоксилата, биосинтез пирувата).
2. Метаболизм аминокислот (цистеин, фенилаланин, аланин, аспартат, серин, глутамат, триптофан, лизин), включая активность трансаминаз.
3. Структура и функция нейронов (биосинтез сфинголипидов, миелина, ГАМК).
4. Гомеостаз синергических витамину B6 микронутриентов (таких как магний, тетра-гидрофолат, гем, селен, НАДФ, молибдоптерин) [52].
Экспериментальные и клинические исследования подтверждают суммированные выше результаты протеомного анализа. P-5-P-зависимые ферменты пиридоксалькиназа, P-5-P-оксидаза и ряд P-5-P-фосфатаз необходимы для метаболизации поступающего с пищей ви-тамина B6, и врожденные дефекты в соответствующих генах вызывают недостаточность P-5-P в нейронах. Внутриклеточный дефицит P-5-P увеличивает возбудимость клеток Пурки-нье мозжечка [53] и участвует в формировании неонатальной эпилептической энцефалопа-тии. Это заболевание не реагирует на обычные противоэпилептические препараты, но зача-стую эффективно лечится P-5-P, пиридоксином и другими витамерами B6 в соответствую-щих дозировках [54].
Дефицит витамина B6 связан с существенными нарушениями метаболизма амино-кислот в ЦНС. У пациентов с витамин-B6-зависимой эпилепсией отмечаются сниженные концентрации серина и глицина в головном мозге [55]. Дефицит витамина B6 ассоциирован с центральными нарушениями проведения возбуждающих импульсов, обусловленными нарушениями обмена аспартата и глутамата [56]. Наследственная гомоцистинурия также связана с дефицитом витамина B6 (B6-зависимая форма). При раннем выявлении этого забо-левания и своевременной коррекции P-5-P в высоких (терапевтических) дозах можно избе-жать развития тяжелых неврологических и сосудистых осложнений. Применение высоких доз витамина В6 значительно облегчает симптомы дистонии конечностей и улучшает по-ходку у таких пациентов [57].
Экспериментальное исследование, проводимое на мышах с созданием рациона пита-ния с низким содержанием витаминов B1, В6 и B9 и высокой концентрацией метионина вызывала нейродегенеративные изменения и последующую потерю кратковременной памя-ти у грызунов. Нарушение мозгового кровообращения на фоне такой диеты происходило вследствие микроваскулярной утечки из-за повышенной проницаемости пиальных сосудов мягкой мозговой оболочки и снижения экспрессии эндотелиального кадхерина сосудов на фоне снижения активности нейрональной NO- синтетазы [58].
Еще одно исследование in vivo на крысах установило, что пренатальное развитие нейронов при дефиците витамина B6 связано с уменьшением общего количества нормаль-ных нейронов в неокортексе и с увеличением процента сморщенных нейронов (700–1500% от контроля). Недостаток витамина B6 приводил к снижению количества дендритов более высокой иерархии и синапсов с более низкой плотностью в неокортексе, а также нарушени-ям организации клеток Пуркинье в мозжечке и уменьшению количества миелинизирован-ных аксонов [59].
Экспериментальная модель ишемии на фоне недостаточного поступления витамина B6 с пищей стимулировала снижение концентрации нейротрофического фактора головного мозга BDNF, количество делящихся нейронов и нейробластов. При этом одновременно уве-личивался уровень гомоцистеина, показатели окислительного стресса и степень поврежде-ния нейронов [60].
При недостатке пиридоксина возникает дистальная симметричная, преимущественно сенсорная, полиневропатия, проявляющаяся ощущением онемения и парестезиями [61]. Так, в исследовании M. Eckert, P. Schejbal отмечено значительное уменьшение интенсивности боли и парестезий на фоне лечения комплексом витаминов группы В (пиридоксин, тиамин, цианокобаламин) пациентов с болевыми синдромами и парестезиями, обусловленными по-линевропатиями, невралгиями, радикулопатиями и мононевропатиями [62].
Пиридоксин улучшает когнитивные функции мозга [63]. В исследовании Оксфорд-ского университета показано, что применение высоких доз витамина В6, В12 и В9 способ-ствовало снижению скорости деменции у пожилых людей с легкими признаками когнитив-ных нарушений [64].
Как уже было выше сказано, витамин В6 необходим для синтеза нейротрансмиттеров – серотонина и норадреналина. Существует зависимость между депрессивными состояния-ми, раздражительностью и недостатком витамина В6. Поэтому применение пиридоксина повышает устойчивость к депрессивным состояниям, повышает концентрацию и внимание [65]. Дефицит пиридоксина снижает уровень серотонина, который поддерживает стабиль-ность в настроении. При сильном стрессе организм запускает выработку гормонов стресса надпочечниками, которые способствуют интенсивному белковому обмену, чтобы бороться со стрессовыми факторами. В таком состоянии расходы пиридоксина увеличиваются в разы. Поэтому необходимо употреблять витамин В6 людям, подверженным высокому нервному напряжению [66].
Поскольку пиридоксин не накапливается в организме, то он должен поступать с пи-щей постоянно. Особенно уязвимыми становятся любители всевозможных диет: пиридок-син быстро расходуется, а поступает его очень мало. Однако применение витаминов группы В является патогенетически обоснованным и при отсутствии их дефицита в связи с тем, что в виде своих коферментов они принимают активное участие в биохимических процессах, обеспечивающих нормальную функциональную активность различных структур нервной системы. В этой связи витамины группы В часто называют нейротрофическими или нейротропными витаминами.
Магний-L-треонат
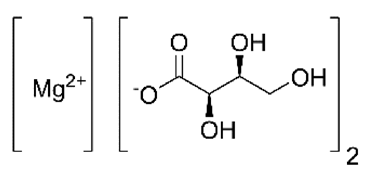
Магний является вторым после калия наиболее распространенным внутриклеточным катионом. По словам известного австралийского нейрофизиолога Роберта Винка, разработка современных неинвазивных методик измерения концентрации свободного внутриклеточно-го магния, а также выяснение его ключевой роли в регуляции рецепторов нейротрансмитте-ров открыли «новую эру магния в нейронауке» [67]. Большое количество обсервационных исследований подтверждает значительную распространенность магниевого дефицита при многих психоневрологических нарушениях, в том числе инсульте, депрессивных и тревож-ных расстройствах, судорожных синдромах, синдроме вегетативной дисфункции и синдро-ме хронической усталости, болезни Паркинсона и болезни Альцгеймера, острой травме го-ловного мозга, мигрени, инсомнии, алкогольной и наркотической интоксикации [68–70]. Предполагают, что дефицит магния часто выступает в качестве одного из этиологических факторов неврологической патологии и усугубляется по мере ее прогрессирования. Будучи задействованным в активном трансмембранном транспорте ионов (Ca2+, Na+, K+), в регу-ляции синтеза и опосредовании эффектов нейротрансмиттеров (ГАМК, глицина, серотони-на, допамина, субстанции Р, сигнальных G-белков), магний влияет на процессы возбужде-ния и торможения в ЦНС, межнейрональной и нервно-мышечной передачи, регулирует си-лу мышечного сокращения [71].
Одним из ключевых механизмов является его способность блокировать ионные каналы NMDA-рецепторов (N-метил-D-аспартат-рецепторы) [72, 73]. Деполяризация постсинаптической мембраны нейрона в условиях взаимодействия глутама-та с NMDA-рецептором «выталкивает» ионы Mg2+ из канала, открывая доступ в клетку ионам Ca2+, активирующим кальмодулин-протеинкиназу II (CaMK-II) с последующим фос-форилированием ряда нейрональных белков. Этот процесс лежит в основе реализации си-наптической пластичности – способности нейронов ЦНС адаптироваться к физиологиче-ским и патологическим воздействиям с помощью регуляции интенсивности транссинапти-ческой передачи: синаптическая пластичность определенных зон головного мозга (гиппо-кампа, коры больших полушарий, миндалины и стриатума) является основой процессов па-мяти и обучения [74, 75].
В то же время гиперактивация синаптических и экстрасинаптических NMDA-рецепторов в условиях дефицита магния может приводить к катастрофическому увеличению интранейро-нальной концентрации Ca2+, стимулирующего активность протеаз, протеинкиназ, NO-синтаз, кальциневрина и эндонуклеаз, нарушение синтеза АТФ. Тем самым внеклеточный дефицит Mg2+ участвует в развитии эксайтотоксичности – одного из механизмов некроти-ческой или апоптотической нейрональной смерти при различных патологических состояни-ях, в том числе при ишемии, травмах головного мозга, нейродегенеративных заболеваниях [76, 77]. К основным составляющим плейотропного нейропротекторного действия магния причисляют такие эффекты [78, 79].
Большинство форм магния не работают как ноотропная биодобавка, потому что они не мо-гут легко преодолеть гематоэнцефалический барьер. Очень часто в литературных источни-ках можно встретить название магний-L-треоната как «нейромагний». Разработанный уче-ными из Массачусетского института Технологии в 2010 году магний-L-треонат рекоменду-ется для ноотропного использования и является отличным дополнением к любой ноотроп-ной комбинации ингредиентов. Магний-L-треонат (MgT) – это магниевая соль треоновой кислоты (C8H14MgO10), которая представляет собой запатентованное соединение. Химическим субстратом выступает L-треоновая кислота, которая является метаболитом витамина С. В формуле есть 2 молекулы L-треоновой кислоты, необходимые для связывания одной мо-лекулы магния (Mg), и таким образом, добавка содержит преумущественно L-треоновую кислоту (хотя это также справедливо и в случае с другими минеральными добавками, таки-ми как цитрат магния, где много лимонной кислоты).
Содержание Mg в веществе незначи-тельное – около 3% – по количеству атомов, но треонат имеет высокие показатели биодо-ступности. По сравнению с другими формами добавок магния магния L-threonate абсорбируется быстрее. Его способность увеличивать уровень магния в головном мозге связана с молекулой L-треоновой кислоты, которая улучшает поглощение витамина С в тканях и мо-жет проходить через гематоэнцефалический барьер, чтобы доставить магний в мозг. Сочета-ние такого транспортного механизма, обладающего ноотропными свойствами, и самого магния обеспечивает такой высокий положительный эффект [80].
В нейрофармакологической статье 2016 года Sun et al. приводятся убедительные доказатель-ства о высокой биодоступности L-треоната магния. В частности, в этой статье показано, что пероральное введение L-треоната магния с питьевой водой увеличивает уровни треоната в спинномозговой жидкости, что свидетельствует о хорошем всасывании соединения. Кроме того, в этой статье было продемонстрировано, что L-треонат эффективен для увеличения интранейронного магния [81].
Прием магния-L-треоната (magnesium-L-threonate, MgT) приводит к значительному увеличе-нию концентрации магния в мозге, улучшает кратковременную и долговременную память молодых и старых крыс, а также повышает их способности к обучению. Исследователи сле-дили за изменениями в поведении животных, получавших магния треонат, и изучали влия-ние повышенных доз магния на мозг крыс на клеточном и молекулярном уровнях. Они по-казали, что улучшение памяти крыс связано с увеличением количества функциональных си-напсов, активации ключевых сигнальных молекул и более благоприятным протеканием кратко- и долговременных синаптических процессов, отвечающих за запоминание. Увели-чение количества магния в мозге с использованием магния (L-треонат магния) приводит к улучшению способностей к обучению, рабочей памяти, а также кратковременной и долго-временной памяти у крыс. Способность к завершению паттерна также улучшилась у старых крыс. Крысы, получавшие магния треонат, имели более высокую плотность синаптофизин-/синаптобревин-позитивных точек в субрегионах DG и CA1 гиппокампа, что коррелировало с улучшением памяти. Результирующая синаптическая реконфигурация позволила выбороч-но улучшить синаптическую передачу для импульсных входов. В сочетании с одновремен-ной активацией рецепторов NMDA, содержащих NR2B, и их последующей передачей сиг-налов, синаптическая пластичность, вызванная коррелированными входами, усиливалась. Результаты исследования показали, что увеличение содержания магния в головном мозге усиливает как краткосрочную синаптическую стимуляцию, так и долгосрочное потенциро-вание, а также улучшает функции обучения и памяти [69].
Исследование 2010 года покало, что, - группа крыс, получавшая, которой давали - магния треонат, лучше сохраняла - память о локализации спрятанного предмета - через 24 часа. У молодых и старых грызунов в контрольной группе поиск в лабиринте занял - в два раза больше времени, чем у крыс, получавшей магния треонат. - [80].
Также новые исследования доказали, что магния треонат может увеличивать нейрогенез у мышей, а значит, теоретически может положительно влиять на нейрогенез у человека [82].
Исследование, опубликованное в «Журнале болезни Альцгеймера» в 2016 году, отмечает положительный эффект, который магния треонат приносит при тревожности, расстройствах сна и когнитивной дисфункции у взрослых людей [83].
В одной из недавних работ Tarleton et al. (2017) продемонстрировали, что 6-недельный при-ем перорального препарата магния 126 пациентами с легкой или умеренной депрессией приводит к клинически значимому улучшению симптомов заболевания на 6 баллов по ре-зультатам PHQ-9 (Patient Depression Questionnaire-9), снижению на 4,5 балла выраженности проявлений генерализованных тревожных расстройств по шкале Generalized Anxiety Disorders-7, а полученный эффект сохраняется в течение 2 недель после окончания приема препарата [84]. Авторы отметили эффективность и хорошую переносимость магния, кото-рый в отличие от традиционных антидепрессантов не нуждался в проведении тщательного мониторинга токсичности.
Рандомизированное двойное слепое плацебо-контролируемое клиническое исследование [85] проводилось в 3 отдельных учреждениях при участии пациентов в возрасте от 50 до 70 лет с задокументированными эпизодами проблем с памятью, расстройств сна и тревоги.
Исследование показало, что атрофия головного мозга является естественной частью старе-ния, но прием биодобавки L-треоната магния, известной как MMFS-01, в течение 12 недель улучшил и даже обратил вспять симптомы в экспериментальной группе [83].
Чтобы прийти к такому выводу, в этом исследовании проводилось тестирование когнитив-ных способностей на первом этапе, а через 6 недель было проведено последующее тестиро-вание. Затем в течение 12 недель исследуемым ежедневно выдавали дозу либо плацебо, либо 1500–2000 мг магния треоната в зависимости от массы тела. Когнитивные тесты повторя-лись с 6- и 12-недельными интервалами в следующих областях: исполнительная функция, рабочая память, внимание, эпизодическая память (способность вспомнить мимолетные события).
Надо отметить, что наиболее значимым результатом является то, что магния треонат не только улучшал показатели индивидуальных тестов познавательных способностей у пожи-лых людей с когнитивными нарушениями, но и служил для «омоложения» постаревшего мозга более чем на девять лет.
Результаты исследования показали 4 значимых эффекта от приема магния треоната:
1. Улучшение уровня магния в организме – через 12 недель в группе, принимавшей препарат, были отмечены: значительное увеличение концентрации магния в эритроцитах, что указывает на высокий уровень циркулирующего магния в организме; и значительный выход магния с мочой, показывающий поглощение большого количества магния.
2. Улучшение когнитивных способностей – показатели визуального внимания и пере-ключения между задачами (в некоторых случаях уже за 6 недель) выявили ускорение испол-нительной функции и когнитивной обработки. Общие показатели резко возросли на 6-й и 12-й неделе по сравнению с первоначальными и с группой плацебо.
3. Уменьшение колебаний когнитивных способностей – познавательные функции, ко-торые могут ухудшаться в некоторые дни, являются одним из признаков развития легкого когнитивного нарушения. Те, кто принимал плацебо, демонстрировали заметные колебания показателей, в то время как в группе магния треонат таких изменений не было выявлено [86].
Последние наблюдения были признаны критически важными из-за связи между потерей синаптической плотности, усыханием мозга и последующим снижением когнитивных спо-собностей [80].
В обзоре, опубликованном в 2013 году, исследователи из нескольких больниц и исследова-тельских центров в Сент-Луисе сообщили, что симптомы расстройств сна, беспокойства и нарушения циркадных ритмов часто встречаются у пациентов с болезнью Альцгеймера [87].
По результатам, амилоидные отложения были связаны с ухудшением качества сна, в частно-сти, его более низкой эффективностью (процент времени, проведенного в постели в состоя-нии сна) по сравнению с теми, у кого отложений не было, хотя время сна было схожим в обеих группах. Важно отметить, что «частая дремота ассоциировалась с амилоидными отложениями».
Треонат естественным образом присутствует в спинномозговой жидкости, и пероральный прием треоната сопровождался повышением его содержания в спинномозговой жидкости. В культуре нейронов гиппокампа обработка треонатом напрямую индуцировала увеличение внутриклеточной концентрации Mg2+. Функциональное повышение уровня треоната по-вышало экспрессию NR2B-содержащего NMDAR, повышало потенциал митохондриальной мембраны (ΔΨm) и увеличивало функциональную плотность синапсов в культурах нейро-нов. Эти эффекты уникальны для треоната, поскольку другие распространенные анионы Mg2+ не давали таких же результатов. Механически эффекты треоната были специфически опосредованы переносчиками глюкозы. При оценке влияния треоната на нейроны, полу-ченные из нервных стволовых клеток человека, обнаружено, что он одинаково эффективен в повышении плотности синапсов. Настоящее исследование дает объяснение того, почему треонат является важным компонентом магния L-треоната, и может быть использован для улучшения когнитивных способностей человека [69].
Заключение
Таким образом, благодаря высокой метаболической активности, участию во всех ос-новных функциях нервной системы, плейотропному нейропротекторному действию, в том числе способности предупреждать прогрессирование нейродегенеративных заболеваний, противодействуя процессам нейрогенного воспаления и эксайтотоксичности, нейронутри-енты играют важнейшую роль в комплексной профилактике и лечении неврологической патологии. Анализ данных экспериментальных и клинических исследований свидетель-ствует о том, что в условиях все возрастающей распространенности пищевых дефицитов микронутриентов. Их адекватная коррекция является одним из ключевых компонентов успешной терапии большинства неврологических состояний, способствует противодей-ствию стрессовым факторам, позволяет предотвратить потерю когнитивных функций, по-могает бороться с болью, тревожностью и депрессией, сопровождающей различную сомати-ческую патологию, значительно улучшить качество жизни пациентов.
Список литературы / References
- Magistretti PJ, Allaman I. A cellular perspective on brain energy metabolism and functional imaging. Neuron. 2015 May 20;86(4):883–901. DOI: 10.1016/j.neuron.2015.03.035
- Kann O, Papageorgiou IE, Draguhn A. Highly energized inhibitory interneurons are a central element for information processing in cortical networks. J .Cereb. Blood Flow Metab. 2014 Aug;34(8):1270–82. Doi: 10.1038/jcbfm.2014.104
- Studenikin V.M., Gribakin S.G. Shelkovsky V.I., Pak L.A. Neurodietology of childhood. – M., Dynasty, 2012. – 672 p.
- Studenikin V. M. New in pediatric neurodietology. Attending Doctor. 2021; 9(24):6–8. DOI: 10.51793/OS.2021.24.9.001
- Pyreva E.A., Sorvacheva T.N. Safronova A.N. Nutritional support in the treatment of children with neurological pathology. Issues of children's dietology. – 2016. – T. 14(1). – From 47–52.
- Magistretti P.J. Brain energy metabolism. In Fundamental neuroscience. Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297.
- Nogueira-de-Almeida CA, Zotarelli-Filho IJ, Nogueira-de-Almeida ME, Souza CG, Kemp VL, Ramos WS. Neuronutrients And Central Nervous System: A Systematic Review. Cent Nerv Syst Agents Med Chem. 2022 Nov 21. DOI: 10.2174/1871524923666221121123937
- Jorgensen E.M. GABA. WormBook. 2005, vol. 31, pp. 1–13.
- Spiering MJ. The discovery of GABA in the brain. J. Biol. Chem. 2018 Dec 7;293(49):19159–19160. DOI: 10.1074/jbc.CL118.006591
- Roth FC, Draguhn A. GABA metabolism and transport: effects on synaptic efficacy. Neural Plast. 2012;2012:805830. DOI: 10.1155/2012/805830
- Hensch TK, Fagiolini M, Mataga N, Stryker MP, Baekkeskov S, Kash SF. Local GABA circuit control of experience-dependent plasticity in developing visual cortex. Science. 1998 Nov 20;282(5393):1504–8. DOI: 10.1126/science.282.5393.1504
- Behar TN, Schaffner AE, Scott CA, Greene CL, Barker JL. GABA receptor antagonists modulate postmitotic cell migration in slice cultures of embryonic rat cortex. Cereb. Cortex. 2000 Sep;10(9):899–909. DOI: 10.1093/cercor/10.9.899
- Trigo FF, Chat M, Marty A. Enhancement of GABA release through endogenous activation of axonal GABA(A) receptors in juvenile cerebellum. J. Neurosci. 2007 Nov 14;27(46):12452–63. DOI: 10.1523/JNEUROSCI.3413-07.2007
- Behar TN, Li YX, Tran HT, Ma W, Dunlap V, Scott C, Barker JL. GABA stimulates chemotaxis and chemokinesis of embryonic cortical neurons via calcium-dependent mechanisms. J. Neurosci. 1996 Mar 1;16(5):1808–18. DOI: 10.1523/JNEUROSCI.16-05-01808.1996
- Owens DF, Kriegstein AR. Developmental neurotransmitters? Neuron. 2002 Dec 19;36(6):989–91. DOI: 10.1016/s0896-6273(02)01136-4
- Represa A, Ben-Ari Y. Trophic actions of GABA on neuronal development. Trends Neurosci. 2005 Jun;28(6):278–83. DOI: 10.1016/j.tins.2005.03.010
- Staley KJ, Soldo BL, Proctor WR. Ionic mechanisms of neuronal excitation by inhibitory GABAA receptors. Science. 1995 Aug 18;269(5226):977–81. DOI: 10.1126/science.7638623
- Wang J, Reichling DB, Kyrozis A, MacDermott AB. Developmental loss of GABA- and glycine-induced depolarization and Ca2+ transients in embryonic rat dorsal horn neurons in culture. Eur. J. Neurosci. 1994 Aug 1;6(8):1275–80. DOI: 10.1111/j.1460-9568.1994.tb00317.x
- Obrietan K, van den Pol AN. GABA neurotransmission in the hypothalamus: developmental reversal from Ca2+ elevating to depressing. J. Neurosci. 1995 Jul;15(7 Pt 1):5065–77. DOI: 10.1523/JNEUROSCI.15-07-05065.1995
- van den Pol AN, Obrietan K, Chen G. Excitatory actions of GABA after neuronal trauma. J Neurosci. 1996 Jul 1;16(13):4283–92. DOI: 10.1523/JNEUROSCI.16-13-04283.1996
- Nuss P. Anxiety disorders and GABA neurotransmission: a disturbance of modulation. Neuropsychiatr Dis Treat. 2015 Jan 17;11:165–75. DOI: 10.2147/NDT.S58841
- Boonstra E, de Kleijn R, Colzato LS, Alkemade A, Forstmann BU, Nieuwenhuis S. Neurotransmitters as food supplements: the effects of GABA on brain and behavior. Front Psychol. 2015 Oct 6;6:1520. DOI: 10.3389/fpsyg.2015.01520
- Furuya S. An essential role for de novo biosynthesis of L-serine in CNS development. Asia Pac J. Clin. Nutr. 2008;17 Suppl 1:312-5. PMID: 18296366.
- Nesterov S.V., Yaguzhinsky L.S., Podoprigora G.I., Nartsissov Y.R. Autocatalytic cycle in the pathogenesis of diabetes mellitus: biochemical and pathophysiological aspects of metabolic therapy with natural amino acids on the example of glycine. Diabetes mellitus. 2018;21(4):283–292.
- Yalkowsky S.H. Handbook of aqueous solubility data / S.H.Yalkowsky, H. Yan. – CRC Press, 2003. – С. 581–582 с.
- Yakovlev V.N. Normal Physiology: Self-study Modules students: Textbook - 5th ed., Revised. and additional / ed. Yakovlev. – Voronezh: IPF "XXI century", 2012. – 600 p.
- Minaeva N.N., Litvintseva E.M. Laboratory work in organic chemistry. Khabarovsk: Publishing House of GBOU VPO FESMU, 2013. – 127 p.
- Selivanova O.S., Napalkova S.M. Glycine as a cytoprotective agent in experimental gentamicin nephropathy. News of higher educational institutions. Volga region. Medical Sciences. 2007. – No. 1. – S. 76–82.
- Cruz M, Maldonado-Bernal C, Mondragón-Gonzalez R, Sanchez-Barrera R, Wacher NH, Carvajal-Sandoval G, Kumate J. Glycine treatment decreases proinflammatory cytokines and increases interferon-gamma in patients with type 2 diabetes. J Endocrinol Invest. 2008 Aug;31(8):694–9. DOI: 10.1007/BF03346417
- Sekhar RV, McKay SV, Patel SG, Guthikonda AP, Reddy VT, Balasubramanyam A, Jahoor F. Glutathione synthesis is diminished in patients with uncontrolled diabetes and restored by dietary supplementation with cysteine and glycine. Diabetes Care. 2011 Jan;34(1):162–7. DOI: 10.2337/dc10-1006
- Baeva E.S. Glycine and its role in the human body // Scientific forum: Medicine, biology and chemistry: Sat. Art. Based on materials of the XXII int. scientific-practical. conf. - No. 4(22). – M., Ed. "MTsNO", 2019. – S. 59–63.
- Banderet LE, Lieberman HR. Treatment with tyrosine, a neurotransmitter precursor, reduces environmental stress in humans. Brain Res Bull. 1989 Apr;22(4):759–62. DOI: 10.1016/0361-9230(89)90096-8
- Клиническая генетика: учебник / Н.П. Бочков, В.П. Пузырев, С.А. Смирнихина; под ред. Н.П. Бочкова. – 4-е изд., доп. и перераб. – М.: ГЭОТАР-Медиа, 2011. – 592 с. Clinical genetics: textbook / N.P. Bochkov, V.P. Puzyrev, S.A. Smirnikhina; ed. N.P. Bochkov. – 4th ed., add. and reworked. – M.: GEOTAR-Media, 2011. – 592 p.
- Holme E, Lindstedt S. Tyrosinaemia type I and NTBC (2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione). J. Inherit. Metab. Dis. 1998 Aug;21(5):507–17. DOI: 10.1023/a:1005410820201
- Semenov A.A. Fundamentals of chemistry of natural compounds: in 2 volumes / A.A. Semenov, V.G. Kartsev. – M.: ICSPF, 2009. – V. 1. – ISBN 978-5-903078-12-7; V. 2. – ISBN 978-5-903078-13-4.
- Alekseev V.V. Medical laboratory technologies: a guide to clinical laboratory diagnostics: in 2 volumes / V.V. Alekseev and others; ed. A.I. Karpishchenko. – 3rd ed. revised and additional – M.: GEOTAR-Media, 2013. – V. 2. – 792 p. - ISBN 978-5-9704-2275-5 (Vol. 2).
- Oslopov V.N. Case history of a therapeutic patient / V.N. Oslopov, O.V. Bogoyavlenskaya, Yu.V. Oslopov. - 2nd ed., Rev. and additional – M.: MEDpressinform, 2013. – 152 p. – ISBN 978-5-98322-967-9-27.
- Ellaway CJ, Holme E, Standing S, Preece MA, Green A, Ploechl E, Ugarte M, Trefz FK, Leonard JV. Outcome of tyrosinaemia type III. J. Inherit Metab Dis. 2001 Dec;24(8):824–32. DOI: 10.1023/a:1013936107064
- Wiedeman AM, Barr SI, Green TJ, Xu Z, Innis SM, Kitts DD. Dietary Choline Intake: Current State of Knowledge Across the Life Cycle. Nutrients. 2018 Oct 16;10(10):1513. DOI: 10.3390/nu10101513
- D'Orlando KJ, Sandage BW Jr. Citicoline (CDP-choline): mechanisms of action and effects in ischemic brain injury. Neurol Res. 1995 Aug;17(4):281–4. DOI: 10.1080/01616412.1995.11740327
- Zempleni J., Suttie J.W., Gregory J.F. 3rd, Stover P.J. (eds.). Handbook of vitamins. CRC Press, 2013.
- Li Q, Guo-Ross S, Lewis DV, Turner D, White AM, Wilson WA, Swartzwelder HS. Dietary prenatal choline supplementation alters postnatal hippocampal structure and function. J. Neurophysiol. 2004 Apr;91(4):1545–55. DOI: 10.1152/jn.00785.2003
- Zeisel SH. A brief history of choline. Ann Nutr Metab. 2012;61(3):254–8. DOI: 10.1159/000343120
- Niculescu MD, Craciunescu CN, Zeisel SH. Dietary choline deficiency alters global and gene-specific DNA methylation in the developing hippocampus of mouse fetal brains. FASEB J. 2006 Jan;20(1):43–9. DOI: 10.1096/fj.05-4707com
- Corbin KD, Zeisel SH. Choline metabolism provides novel insights into nonalcoholic fatty liver disease and its progression. Curr Opin Gastroenterol. 2012 Mar;28(2):159–65. DOI: 10.1097/MOG.0b013e32834e7b4b
- Inazu M. Functional Expression of Choline Transporters in the Blood-Brain Barrier. Nutrients. 2019 Sep 20;11(10):2265. DOI: 10.3390/nu11102265
- Ueland PM. Choline and betaine in health and disease. J. Inherit Metab Dis. 2011 Feb;34(1):3–15. DOI: 10.1007/s10545-010-9088-4
- Rand JB. Acetylcholine. WormBook. 2007 Jan 30:1–21. DOI: 10.1895/wormbook.1.131.1
- Picciotto MR, Higley MJ, Mineur YS. Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior. Neuron. 2012 Oct 4;76(1):116–29. doi: 10.1016/j.neuron.2012.08.036
- Chen J, Cheuk IWY, Shin VY, Kwong A. Acetylcholine receptors: Key players in cancer development. Surg Oncol. 2019 Dec;31:46-53. doi: 10.1016/j.suronc.2019.09.003.
- Vogt N. Detecting acetylcholine. Nat Methods. 2018 Sep;15(9):648. DOI: 10.1038/s41592-018-0131-y
- Gromova OA, Torshin IYu, Gusev EI. Sinergidnye nejroprotektornye effekty tiamina, piridoksina i tsianokobalamina v ramkakh proteoma cheloveka.Farmakokinetika i farmakodinamika. 2017;(1):40–51.
- Bolaños-Burgos IC, Bernal-Correa AM, Mahecha GAB, Ribeiro ÂM, Kushmerick C. Thiamine Deficiency Increases Intrinsic Excitability of Mouse Cerebellar Purkinje Cells. Cerebellum. 2021 Apr;20(2):186–202. Doi: 10.1007/s12311-020-01202-x
- Ghatge MS, Al Mughram M, Omar AM, Safo MK. Inborn errors in the vitamin B6 salvage enzymes associated with neonatal epileptic encephalopathy and other pathologies. Biochimie. 2021 Apr;183:18–29. Doi: 10.1016/j.biochi.2020.12.025
- Ramos RJ, Pras-Raves ML, Gerrits J, van der Ham M, Willemsen M, Prinsen H, Burgering B, Jans JJ, Verhoeven-Duif NM. Vitamin B6 is essential for serine de novo biosynthesis. J. Inherit Metab Dis. 2017 Nov;40(6):883–891. DOI: 10.1007/s10545-017-0061-3 .
- Claus D, Neundörfer B, Warecka K. The influence of vitamin B6 deficiency on somatosensory stimulus conduction in the rat. Eur. Arch Psychiatry Neurol Sci. 1984;234(2):102–5. DOI: 10.1007/BF00381215
- Rezazadeh A, Oveisgharan S, Shahidi G, Naghdi R. A Case Report of Homocystinuria With Dystonia and Stroke. Child Neurol. Open. 2014 Aug 26;1(1):2329048X14545870. DOI: 10.1177/2329048X14545870
- Nuru M, Muradashvili N, Kalani A, Lominadze D, Tyagi N. High methionine, low folate and low vitamin B6/B12 (HM-LF-LV) diet causes neurodegeneration and subsequent short-term memory loss. Metab Brain Dis. 2018 Dec;33(6):1923–1934. DOI: 10.1007/s11011-018-0298-z
- Kirksey A, Morré DM, Wasynczuk AZ. Neuronal development in vitamin B6 deficiency. Ann N Y Acad. Sci. 1990;585:202–18. DOI: 10.1111/j.1749-6632.1990.tb28054.x
- Jung HY, Kim W, Hahn KR, Kang MS, Kim TH, Kwon HJ, Nam SM, Chung JY, Choi JH, Yoon YS, Kim DW, Yoo DY, Hwang IK. Pyridoxine Deficiency Exacerbates Neuronal Damage after Ischemia by Increasing Oxidative Stress and Reduces Proliferating Cells and Neuroblasts in the Gerbil Hippocampus. Int J. Mol. Sci. 2020 Aug 4;21(15):5551. DOI: 10.3390/ijms21155551
- Akhmedzhanova L.T., Solokha O.A., Strokov I.A. B vitamins in the treatment of neurological diseases. RMJ 2009;17(11):776–83.
- Eckert M, Schejbal P. Therapie von Neuropathien mit einer Vitamin-B-Kombination. Symptomatische Behandlung von schmerzhaften Erkrankungen des peripheren Nervensystems mit einem Kombinationspräparat aus Thiamin, Pyridoxin und Cyanocobalamin [Therapy of neuropathies with a vitamin B combination. Symptomatic treatment of painful diseases of the peripheral nervous system with a combination preparation of thiamine, pyridoxine and cyanocobalamin]. Fortschr Med. 1992 Oct 20;110(29):544–8.
- Malouf R, Grimley Evans J. The effect of vitamin B6 on cognition. Cochrane Database Syst Rev. 2003;(4):CD004393. doi: 10.1002/14651858.CD004393
- Kennedy DO. B Vitamins and the Brain: Mechanisms, Dose and Efficacy--A Review. Nutrients. 2016 Jan 27;8(2):68. DOI: 10.3390/nu8020068
- Field DT, Cracknell RO, Eastwood JR, Scarfe P, Williams CM, Zheng Y, Tavassoli T. High-dose Vitamin B6 supplementation reduces anxiety and strengthens visual surround suppression. Hum Psychopharmacol. 2022 Nov;37(6):e2852. DOI: 10.1002/hup.2852
- Dakshinamurti S., Dakshinamurti K. Vitamin b6. In: Zempleni J., Suttie J.W., Gregory J.F. III, Stover P.J., editors. Handbook of Vitamins. 5th ed. CRC Press; Boca Raton, FL, USA: 2013.
- Turner RJ, Vink R. Magnesium in the central nervous system New Perspectives in Magnesium Research: Nutrition and Health. 338–355. DOI: 10.1007/978-1-84628-483-0_28
- Touvier M, Lioret S, Vanrullen I, Boclé JC, Boutron-Ruault MC, Berta JL, Volatier JL. Vitamin and mineral inadequacy in the French population: estimation and application for the optimization of food fortification. Int J Vitam Nutr Res. 2006 Nov;76(6):343–51. DOI: 10.1024/0300-9831.76.6.343
- Vink R. Magnesium in the CNS: recent advances and developments. Magnes Res. 2016 Mar 1;29(3):95–101. DOI: 10.1684/mrh.2016.0408
- Yary T, Lehto SM, Tolmunen T, Tuomainen TP, Kauhanen J, Voutilainen S, Ruusunen A. Dietary magnesium intake and the incidence of depression: A 20-year follow-up study. J. Affect Disord. 2016 Mar 15;193:94–8. DOI: 10.1016/j.jad.2015.12.056
- DiNicolantonio JJ, O'Keefe JH, Wilson W. Subclinical magnesium deficiency: a principal driver of cardiovascular disease and a public health crisis. Open Heart. 2018 Jan 13;5(1):e000668. doi: 10.1136/openhrt-2017-000668. Erratum in: Open Heart. 2018 Apr 5;5(1):e000668corr1.
- Vink R, Nechifor M, editors. Magnesium in the Central Nervous System [Internet]. Adelaide (AU): University of Adelaide Press; 2011. PMID: 29919999. www.adelaide.edu.au/press.
- Guerrera MP, Volpe SL, Mao JJ. Therapeutic uses of magnesium. Am Fam Physician. 2009 Jul 15;80(2):157–62.
- Slutsky I, Sadeghpour S, Li B, Liu G. Enhancement of synaptic plasticity through chronically reduced Ca2+ flux during uncorrelated activity. Neuron. 2004 Dec 2;44(5):835–49. DOI: 10.1016/j.neuron.2004.11.013
- Zhou H, Liu G. Regulation of density of functional presynaptic terminals by local energy supply. Mol Brain. 2015 Jul 17;8:42. DOI: 10.1186/s13041-015-0132-z. Erratum in: Mol Brain. 2015;8:45.
- Léveillé F, El Gaamouch F, Gouix E, Lecocq M, Lobner D, Nicole O, Buisson A. Neuronal viability is controlled by a functional relation between synaptic and extrasynaptic NMDA receptors. FASEB J. 2008 Dec;22(12):4258–71. DOI: 10.1096/fj.08-107268
- Szydlowska K, Tymianski M. Calcium, ischemia and excitotoxicity. Cell Calcium. 2010 Feb;47(2):122–9. DOI: 10.1016/j.ceca.2010.01.003
- Chang JJ, Mack WJ, Saver JL, Sanossian N. Magnesium: potential roles in neurovascular disease. Front Neurol. 2014 Apr 15;5:52. DOI: 10.3389/fneur.2014.00052
- Herroeder S, Schönherr ME, De Hert SG, Hollmann MW. Magnesium--essentials for anesthesiologists. Anesthesiology. 2011 Apr;114(4):971–93. DOI: 10.1097/ALN.0b013e318210483d
- Slutsky I, Abumaria N, Wu LJ, Huang C, Zhang L, Li B, Zhao X, Govindarajan A, Zhao MG, Zhuo M, Tonegawa S, Liu G. Enhancement of learning and memory by elevating brain magnesium. Neuron. 2010 Jan 28;65(2):165–77. DOI: 10.1016/j.neuron.2009.12.026
- Sun Q, Weinger JG, Mao F, Liu G. Regulation of structural and functional synapse density by L-threonate through modulation of intraneuronal magnesium concentration. Neuropharmacology. 2016 Sep;108:426–39. DOI: 10.1016/j.neuropharm.2016.05.006
- Li W, Yu J, Liu Y, Huang X, Abumaria N, Zhu Y, Huang X, Xiong W, Ren C, Liu XG, Chui D, Liu G. Elevation of brain magnesium prevents synaptic loss and reverses cognitive deficits in Alzheimer's disease mouse model. Mol. Brain. 2014 Sep 13;7:65. DOI: 10.1186/s13041-014-0065-y
- Liu G, Weinger JG, Lu ZL, Xue F, Sadeghpour S. Efficacy and Safety of MMFS-01, a Synapse Density Enhancer, for Treating Cognitive Impairment in Older Adults: A Randomized, Double-Blind, Placebo-Controlled Trial. J. Alzheimers Dis. 2016;49(4):971–90. DOI: 10.3233/JAD-150538
- Tarleton EK, Littenberg B, MacLean CD, Kennedy AG, Daley C. Role of magnesium supplementation in the treatment of depression: A randomized clinical trial. PLoS One. 2017 Jun 27;12(6):e0180067. DOI: 10.1371/journal.pone.0180067
- Tsapanou A, Vlachos GS, Cosentino S, Gu Y, Manly JJ, Brickman AM, Schupf N, Zimmerman ME, Yannakoulia M, Kosmidis MH, Dardiotis E, Hadjigeorgiou G, Sakka P, Stern Y, Scarmeas N, Mayeux R. Sleep and subjective cognitive decline in cognitively healthy elderly: Results from two cohorts. J. Sleep Res. 2019 Oct;28(5):e12759. DOI: 10.1111/jsr.12759
- Lin L, Jin C, Fu Z, Zhang B, Bin G, Wu S. Predicting healthy older adult's brain age based on structural connectivity networks using artificial neural networks. Comput Methods Programs Biomed. 2016 Mar;125:8–17. DOI: 10.1016/j.cmpb.2015.11.012
- Sale A, Berardi N, Maffei L. Environment and brain plasticity: towards an endogenous pharmacotherapy. Physiol. Rev. 2014 Jan;94(1):189–234. doi: 10.1152/physrev.00036.2012
Сведения об авторах
Орлова Светлана Владимировна, д.м.н., проф., зав. кафедрой диетологии и клинической нутрициологии, главный научный сотрудник1, 2.E-mail: orlova-sv@rudn.ru. ORCID: 0000-0002-4689-3591
Никитина Елена Александровна, к.м.н., доцент кафедры диетологии и клинической нутрициологии научный сотрудник1, 2. E-mail: nikitina-ea1@rudn.ru. ORCID: 0000-0003-3220-0333
Балашова Наталья Валерьевна, к.б.н., ассистент доцент кафедры диетологии и клинической нутрициологии ФГАОУ ВО «Российский университет дружбы народов», 117198, Москва, ул. Миклухо-Маклая, д. 6; balashovaN77@mail.ru. ORCID: 0000-0002-0548-3414.
Грибакин Сергей Германович, д.м.н., профессор кафедры диетологии и нутрициологии1. E-mail: serg.gribakin2016@yandex.ru. ORCID: 0000-0002-3738-3792
Прокопенко Елена Валерьевна, врач-эндокринолог, диетолог, ведущий менеджер проектов медицинского департамента4. E-mail: elvprokopenko@gmail.com. ORCID: 0000-0002-3811-9459.
Водолазкая Ангелина Николаевна, врач-диетолог5. E-mail: drvodolazkaya@gmail.com. ORCID: 0000-0002-5203-1082.
Пигарева Юлия Анатольевна, к.м.н., зав. отделением клиническойдиетологии6. E-mail: 1092153068@rudn.ru. ORCID: 0000-0003-4749-731X
1 ФГАОУ ВО «Российский университет дружбы народов»(РУДН), Москва
2 ГБУЗ «Научно-практический центр детской психоневрологии Департамента здравоохранения г. Москвы», Россия
3 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
4 ООО «ИНВИТРО», Москва, Россия
5 Австрийская клиника микронутриентной терапии Biogena, Москва
6 ГБУЗ «Городская клиническая больница имени В.В. Виноградова Департамента здравоохранения Москвы», Россия
Автор для переписки: Орлова Светлана Владимировна. E-mail: rudn_nutr@mail.ru
Abouts authors
Orlova Svetlana V., DM Sci (habil.), professor, head of Dept of Dietetics and Clinical Nutritiology, Chief Researcher1, 2. E-mail: rudn_nutr@mail.ru. ORCID: 0000-0002-4689-3591
Nikitina Elena A., PhD Med, assistant professor of Dept of Dietetics and Clinical Nutritiology, Researcher1, 2. E-mail: nikitina-ea1@rudn.ru. ORCID: 0000-0003-3220-0333
Balashova Natalya V., PhD Bio Sci, assistant of Dept of Dietetics and Clinical Nutritiology1. E-mail: balashovaN77@mail.ru. ORCID: 0000-0002-0548-3414
Gribakin Sergey G., DM Sci (habil.), professor of the Dept of Dietology and Nutrition1. E-mail: serg.gribakin2016@yandex.ru. ORCID: 0000-0002-3738-3792.
Prokopenko Elena V., endocrinologist, dietitian, Project Manager of Medical Department4. E-mail: elvprokopenko@gmail.com, ORCID: 0000-0002-3811-9459
Vodolazkaya Angelina N., dietitian5. E-mail: drvodolazkaya@gmail.com. ORCID: 0000-0002-5203-1082
Pigareva Yulia A., PhD Med, head of Dept of Clinical Dietetics6. E-mail: yupigareva@yandex.ru. ORCID: 0000-0003-4749-731X
1 Peoples' Friendship University of Russia, Moscow, Russia
2 Scientific and Practical Center for Child Psychoneurology, Moscow Department of Health, Russia
3 Russian Medical Academy of Continious Professional Education, Moscow, Russia
4 INVITRO” Limited Liability Company, Moscow, Russia
5 Austrian clinic for micronutrient therapy Biogena, Moscow, Russia
6 City Clinical Hospital n.a. V.V. Vinogradov, Moscow, Russia
Corresponding author: Orlova Svetlana V. E-mail: rudn_nutr@mail.ru




